宁夏无芒稗对光周期的响应与适应
采用盆栽试验研究了不同光周期(8、10、12、14、16 h·d−1)对宁夏无芒稗(Echinochloa crusgalli)生理特性的影响,通过揭示光周期对其生长发育的调控机理,寻找最适光周期,以期为其科学引种及高产栽培提供指导。结果表明:1)在16 h·d−1光周期处理下,宁夏无芒稗的生育期显著延长。2)随光照时间延长,其地上生物量呈上升趋势;穗重呈“倒V”型变化。3)随光照时间延长,其抗氧化酶活性呈先降后升的趋势;叶绿素含量、净光合速率等呈相反变化;随着生育期的推进,光合色素含量呈下降趋势。综上所述,12 h·d−1光周期处理促进了宁夏无芒稗光合色素的合成,增强了叶片光合能力,促进了植株的生长发育。因此,应将宁夏无芒稗引种种植在光周期12 h·d−1的地区,在较短时间内通过适宜的光照时间更大程度地提高牧草产量。
English
-
光照是植物生命周期中最为重要的生态环境因素之一,为植物生长发育过程提供所需的能量[1]。植物在整个生育期中受到光周期的显著调控,使植物在生长发育过程中与特定环境条件相适应[2-3]。光周期不仅影响植物的光合作用,还作为信号因子直接影响植物整个生育期的发育和生理特性[4-5]。目前,国内外对光周期调控方面的研究发现,光周期不仅在植物从营养生长过渡到生殖生长阶中起着重要作用,还调节植物生长发育过程中的各个阶段[6-7],且在不同的生育阶段所需光照时间也不尽相同[8]。需长日照的生育阶段,短日照处理不利于植物生长,会降低光合色素的形成,在一定程度上抑制了叶片的光合作用,进而阻碍植物生长发育[9-10]。史莹华等[11]研究推测不适宜的光照时间可能作为一种胁迫因子影响苜蓿(Medicago sativa)生长。当植物遭受逆境胁迫时,抗氧化酶在抵御逆境胁迫产生过量的活性氧自由基(reactive oxyradical, ROS)中发挥重要的作用。目前,国内外关于不同光周期处理下植株抗氧化酶活性变化规律的研究鲜见报道,所以从抗氧化酶活性角度出发研究光周期影响稗属牧草生育期各指标改变的机理很有必要。
宁夏无芒稗(Echinochloa crusgalli)原为宁夏地区分布的野生无芒稗,后经人工驯化成为栽培品种,因其具备牧草种子产量和养分含量高等优良品质,现被作为重要的粮草兼用型作物[12]。目前,关于宁夏无芒稗的各项研究较少,大部分研究主要集中在耐盐碱性[13],而缺乏宁夏无芒稗对光周期响应的研究,且无法明确光周期对其生育期及生长生理特性的影响过程,这导致部分引种种植地区出现植株矮小,产量下降等情况,严重制约了区域土地资源合理利用及其畜牧业发展[14-15]。因此,本研究以宁夏无芒稗为研究对象,测定不同光周期处理下宁夏无芒稗拔节、抽穗开花、灌浆的生长指标,并分析不同光周期处理下各发育时期叶片的生理生化指标等,揭示不同光周期对宁夏无芒稗生长发育过程的调控作用,为我国耐盐碱优质牧草宁夏无芒稗的合理栽培及其异地引种提供重要依据,同时为实现盐碱土壤资源改良及可持续利用提供科学依据,能够更大程度实现盐碱土壤资源的合理利用,促进区域畜牧业的大力发展。
1. 材料与方法
1.1 试验材料
试验材料为宁夏草原站提供的禾本科稗属牧草宁夏无芒稗。选取籽粒饱满、大小一致的种子用2% NaClO溶液消毒20 min,蒸馏水冲洗4~5次,最后用滤纸吸干表面水分后种植于营养土体积比为泥炭土 ꞉ 珍珠岩 ꞉ 蛭石 = 1 ꞉ 1 ꞉ 1混合的500 g (干重)基质中。此外,每隔一周浇施一次霍格兰营养液(稀释50倍),以保证全生育期植株正常生长。
1.2 试验设计
试验于2022年3月-6月在宁夏大学人工气候室进行,设置光量子密度为180 μmol·(m2·s)−1,温度为(26 ± 1) ℃/(22 ± 1) ℃(昼/夜),湿度为35%。于2022年3月19日在直径为23 cm、高度为13 cm的花盆中播种,每盆播种20粒宁夏无芒稗种子。待植株出苗一周后进行光周期处理,试验共设置5个光周期处理,分别为8 (Ph8)、10 (Ph10)、12 (Ph12)、14 (Ph14)、16 (Ph16) h·d−1,其中光照时间Ph8为04:00-12:00,Ph10为04:00-14:00,Ph12为 04:00-16:00,Ph14为04:00-18:00,Ph16为04:00-20:00,其余时间均处于黑暗状态,每个处理20株,重复3次,共300株。各光周期处理用遮光布分割成不同的试验区域,避免互相影响。不同处理之间除光周期不同外,其余管理措施均一致。此后,分别测定分析宁夏无芒稗在每个光周期处理下拔节期、抽穗期和灌浆期的生长指标及光合参数。之后,每株选取2~3片功能叶片,用于后续生理生化指标的测定。
1.3 测定项目及方法
1.3.1 生育期
拔节期:当不同光周期处理的盆栽中有1/2的植株拔节时开始记录拔节期;抽穗期:当不同光周期处理的盆栽中有1/2的植株抽穗时开始记录抽穗期;灌浆期:当不同光周期处理的盆栽中有1/2的植株灌浆时开始记录灌浆期。
1.3.2 生长指标
不同生育时期测定植株的株高、叶长、茎粗、叶片数;在抽穗期测量旗叶的叶长、叶宽、叶面积,以及穗长、穗宽和穗重;并计算各生育期的地上生物量,每个光周期处理选取9株(重复3次)。
株高:由植株基部至主茎生长点的自然高度;茎粗:距土面2 cm处的茎秆直径;叶长:由植株倒二叶的叶基部到叶尖的长度;叶片数:叶长大于1 cm的可见叶片数;采用叶面积仪(浙江托普云农科技股份有限公司,智能叶面积测量系统,YMJ-CH)测量旗叶的叶长、叶宽和叶面积;穗长:用直尺测量穗基部至穗顶部的长度;穗宽:用直尺测量植株主穗的最粗处为穗粗;穗重:用精度为0.01 g电子天平称量其穗重;计算各生育期的地上生物量(拔节期:叶 + 茎;抽穗期和灌浆期:叶 + 茎 + 穗)。
1.3.3 细胞膜透性
植株细胞膜透性采用相对电导率法,用DDS-307型电导率仪测定[16]。
1.3.4 抗氧化酶活性
在宁夏无芒稗的不同生育期中,取不同光周期处理的新鲜叶片0.5 g,分2次共加入7 mL磷酸缓冲液,研磨成匀浆,用10 000 r·min−1冷冻离心20 min,取其上清液。其中,超氧化物歧化酶(Superoxide dismutase,SOD)活性采用NBT光还原法[16];过氧化物酶(peroxidase,POD)活性采用愈创木酚法测定[16];过氧化氢酶(catalase,CAT)活性采用紫外吸收法测定[16]。
1.3.5 叶绿素含量
叶绿素a、叶绿素b和类胡萝卜素含量采用95%的乙醇研磨法测定[16]。
1.3.6 光合气体交换参数
宁夏无芒稗的拔节、抽穗和灌浆期,每个处理随机选取9株长势一致、叶片完好的植株,于09:30-11:30采用 Li-6400 XT便携式光合仪(Li-Cor Inc., Lincoln, NE, USA)测定。设定LED红蓝光源,光强为1 000 μmol·(m2·s)−1,使用开放式气路,空气流速设定为500 μmol·s−1,选取从上至下数第3个叶片进行净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)的测定,并利用以下公式计算瞬时水分利用效率(WUE ):
$$ {WUE}={P_{\rm{n}}} / {T_{\rm{r}}} 。$$ 1.4 数据分析
采用Excel 2010整理数据;所有统计分析均使用SPSS 23.0进行,用平均值和标准误表示测定结果,采用单因素方差分析(one-way ANOVA)和双因素方差分析(two-way ANOVA),最后采用Origin 2021制图。
2. 结果与分析
2.1 不同光周期处理对宁夏无芒稗生育进程的影响
不同光周期处理下,宁夏无芒稗完成生育期所需的时间不同(图1)。在光照时间10 h处理下,宁夏无芒稗出苗到灌浆所需的天数最短,仅需60 d。在长日照(16 h)处理下,其所需的天数明显延长,需要89 d。说明较长的光照时间下,宁夏无芒稗的生长缓慢。
2.2 光周期对宁夏无芒稗不同生育时期生长指标的影响
不同光周期处理对宁夏无芒稗各生育期的生长状况均具有重要影响(表1)。其中,在Ph16处理下宁夏无芒稗各生育期的株高、叶长和地上生物量均显著高于其他处理(P < 0.05),但叶片卷曲严重。随着光照时间的延长,在宁夏无芒稗的不同生育期中茎粗和叶片数均呈“先升后降”的变化趋势,在Ph12处理下达到最大。随着生育期的推进,宁夏无芒稗的生长指标均表现为灌浆期 > 抽穗期 > 拔节期。且生育时期和光周期对各生长指标具有极显著影响(P < 0.01),生育时期和光周期交互作用对茎粗和地上生物量的影响极显著(P < 0.01),对株高、叶长和叶片数影响不显著(P > 0.05)。
表 1 不同生育时期和光周期对宁夏无芒稗生长指标的影响Table 1. Effects of different fertility periods and photoperiods on the growth index of Echinochloa crusgalli生育时期
Fertility period光周期处理
Photoperiod time/(h·d−1)株高
Plant height/cm茎粗
Stem diameter/mm叶长
Leaf length/cm叶片数
Leaf number地上生物量
Aboveground biomass/g拔节期
Jointing stage8 (Ph8) 36.67 ± 0.29c 2.61 ± 0.09c 18.73 ± 0.13d 3.47 ± 0.07ab 0.31 ± 0.02e 10 (Ph10) 37.60 ± 0.61bc 3.30 ± 0.18b 20.87 ± 0.47c 3.53 ± 0.13ab 0.38 ± 0.01d 12 (Ph12) 38.20 ± 0.35b 3.96 ± 0.12a 21.53 ± 0.13c 3.73 ± 0.18a 0.52 ± 0.01c 14 (Ph14) 38.93 ± 0.29b 3.61 ± 0.17ab 23.13 ± 0.77b 3.53 ± 0.07ab 0.61 ± 0.01b 16 (Ph16) 49.13 ± 0.47a 3.59 ± 0.04ab 25.40 ± 0.58a 3.20 ± 0.12b 0.84 ± 0.03a 抽穗期
Spike stage8 (Ph8) 39.13 ± 0.44b 2.86 ± 0.21c 20.60 ± 0.31c 3.60 ± 0.12b 0.58 ± 0.02d 10 (Ph10) 39.27 ± 0.24b 3.49 ± 0.11b 21.13 ± 1.00bc 3.67 ± 0.18b 0.62 ± 0.02d 12 (Ph12) 39.73 ± 0.98b 4.19 ± 0.10a 21.73 ± 0.41bc 4.07 ± 0.07a 0.72 ± 0.02c 14 (Ph14) 41.73 ± 0.07b 4.08 ± 0.08a 24.67 ± 0.68b 3.60 ± 0.12b 0.99 ± 0.03b 16 (Ph16) 52.13 ± 1.40a 3.92 ± 0.13a 28.87 ± 0.18a 3.33 ± 0.07b 1.09 ± 0.00a 灌浆期
Grouting stage8 (Ph8) 40.47 ± 0.48c 3.09 ± 0.24d 20.93 ± 0.18c 3.67 ± 0.24b 0.61 ± 0.04d 10 (Ph10) 40.93 ± 0.93bc 3.50 ± 0.20cd 22.33 ± 0.73bc 3.93 ± 0.07b 0.81 ± 0.01c 12 (Ph12) 42.07 ± 0.18bc 5.64 ± 0.21a 22.53 ± 0.81bc 4.53 ± 0.24a 0.87 ± 0.03c 14 (Ph14) 42.47 ± 0.47b 5.00 ± 0.11b 25.40 ± 1.90b 4.13 ± 0.07ab 1.04 ± 0.05b 16 (Ph16) 53.40 ± 0.53a 4.01 ± 0.14c 30.87 ± 0.47a 3.67 ± 0.07b 1.17 ± 0.01a 生育时期 Period of fertility 47.53** 38.54** 14.62** 17.82** 280.28** 光周期 Photoperiod 226.61** 59.29** 60.11** 11.67** 211.14** 生育时期 × 光周期
Period of fertility × photoperiod0.40 5.90** 1.65 0.88 3.39** 不同小写字母表示同一生育期不同光周期处理间差异显著(P < 0.05),**表示具有极显著影响(P < 0.01);下同。
Different lowercase letters for the same fertility period indicate significant differences between different photoperiod treatments at the 0.05 level; ** indicates an extremely significant difference at the 0.01 level; This is applicable for the following figures and tables as well.不同光周期处理对宁夏无芒稗抽穗期的旗叶性状和穗部特征均产生重要影响(表2)。在Ph12处理下,宁夏无芒稗的旗叶长和旗叶面积显著高于其他处理(P < 0.05),分别提高了31.91%、26.03%、39.86%、76.67%和38.83%、35.51%、56.89%、130.59%。而旗叶宽在Ph16处理下显著低于Ph10和Ph12 (P < 0.05),分别下降17.40%和23.87%;较其他光周期处理无显著差异(P > 0.05)。与旗叶面积结果类似,宁夏无芒稗的穗部特征也均呈“倒V”型变化趋势,均在Ph12处理下达到最大。穗重在Ph12处理下显著高于其他处理(P < 0.05),分别上升67.50%、48.89%、34.00%和45.65%,而穗长和穗宽在不同光周期处理间无显著差异(P > 0.05)。这可能是较短或较长日照下,宁夏无芒稗的旗叶面积较小,不利于其进行光合作用,进而导致光合产物不能满足灌浆需求,最终体现在穗重下降。
表 2 光周期处理下宁夏无芒稗生长指标的比较Table 2. Comparison of growth indices of Echinochloa crusgalli under photoperiodic treatment光周期
Photoperiod time/
(h·d−1)旗叶叶长
Length of flag leaf/
mm旗叶叶宽
Width of flag leaf/
mm旗叶面积
Area of flag leaf/
mm2穗长
Spike length/
cm穗宽
Spike width/
cm穗重
Spike weight/
g8 (Ph8) 50.99 ± 0.32c 7.42 ± 0.33ab 329.96 ± 1.32b 3.01 ± 0.04a 0.81 ± 0.02abc 0.40 ± 0.05b 10 (Ph10) 53.37 ± 0.56b 7.76 ± 0.41a 338.05 ± 5.37b 3.12 ± 0.10a 0.84 ± 0.05ab 0.45 ± 0.03b 12 (Ph12) 67.26 ± 0.13a 8.42 ± 0.26a 458.09 ± 3.09a 3.14 ± 0.17a 3.96 ± 0.12a 0.67 ± 0.04a 14 (Ph14) 48.09 ± 0.69d 7.52 ± 0.41ab 291.99 ± 2.65c 3.00 ± 0.06a 3.61 ± 0.17ab 0.50 ± 0.04b 16 (Ph16) 38.07 ± 0.47e 6.41 ± 0.26b 198.66 ± 3.72d 2.83 ± 0.07a 3.59 ± 0.04ab 0.46 ± 0.05b 2.3 光周期对宁夏无芒稗不同生育时期生理生化指标的影响
2.3.1 细胞膜透性
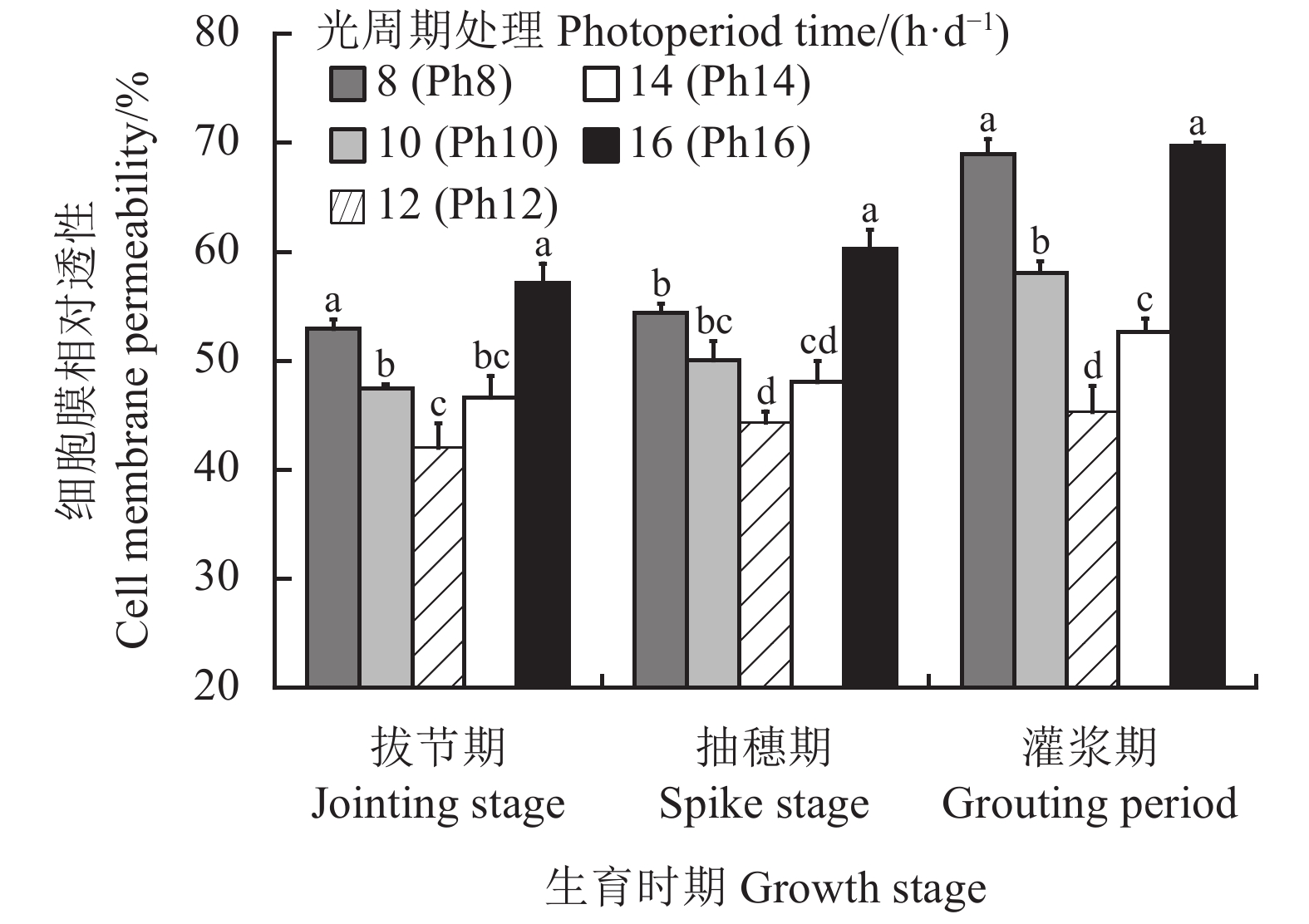
细胞膜透性的大小可以直接反映光照时间对植株细胞膜透性的改变及细胞膜损坏的情况。不同光周期处理对宁夏无芒稗细胞膜透性产生重要的影响(图2)。随着生育进程的推进,宁夏无芒稗的细胞膜透性呈不断增加的变化趋势,表现为灌浆期 > 抽穗期 > 拔节期。且随着光照时间的延长,宁夏无芒稗各生育期的细胞膜透性呈“先降后升”的变化过程,均在Ph12处理下降到最小值,分别为42.02%、45.28%和44.29%。且在Ph12处理下的细胞膜透性显著低于Ph8和Ph16处理(P < 0.05)。
2.3.2 抗氧化酶活性
SOD作为植物体内抗氧化酶体系的核心酶,能够通过催化对细胞有害活性氧和自由基发生歧化反应使活性氧生成H2O和O2,在活性氧清除系统中起到关键作用。如图3所示,随着光照时间的延长,宁夏无芒稗各生育时期的SOD活性均呈“先降后升”的变化趋势。拔节期在Ph16处理下的SOD活性显著高于Ph8、Ph10和Ph12处理(P < 0.05);抽穗期在Ph16处理下显著高于其他处理(P < 0.05);灌浆期在Ph8处理下显著高于Ph12和Ph14处理(P < 0.05),与其他处理无显著差异。说明较短和较长的日照长度激发SOD的活性,从而使得植株叶片的SOD活性升高。
POD作为植物体内的保护酶之一,能够清除细胞内的自由基,其活性的高低可反映某时期植物的代谢及抗逆性。如图3所示,随着生育时期的推进,宁夏无芒稗的POD活性呈“先升后降”的变化趋势。而随着光照时间的延长,宁夏无芒稗各生育时期的POD活性均呈“V”型变化趋势,均表现为Ph8处理下POD活性最高,Ph16次之。说明光胁迫可能会刺激宁夏无芒稗叶片的POD活性升高,从而减轻活性氧对植株细胞的损伤。
CAT能够清除代谢中产生的H2O2,避免H2O2积累对膜系统造成伤害。随着光照时长的增加,宁夏无芒稗各生育期的CAT活性呈“先降后升”的趋势(图3)。拔节期在Ph12处理下CAT活性显著低于其他处理(P < 0.05),分别下降10.19%、6.17%、13.77%和25.27%;抽穗期和灌浆期时,在Ph14处理下显著低于其他处理(P < 0.05),分别下降7.71%、5.59%、5.25%、13.91%和14.37%、9.34%、7.09%、6.92%。说明较短或较长的光照时间可能会刺激宁夏无芒稗叶片的CAT活性升高,以此清除细胞内多余的活性氧,进而保护植株细胞免受伤害(图3)。
2.3.3 叶绿素含量
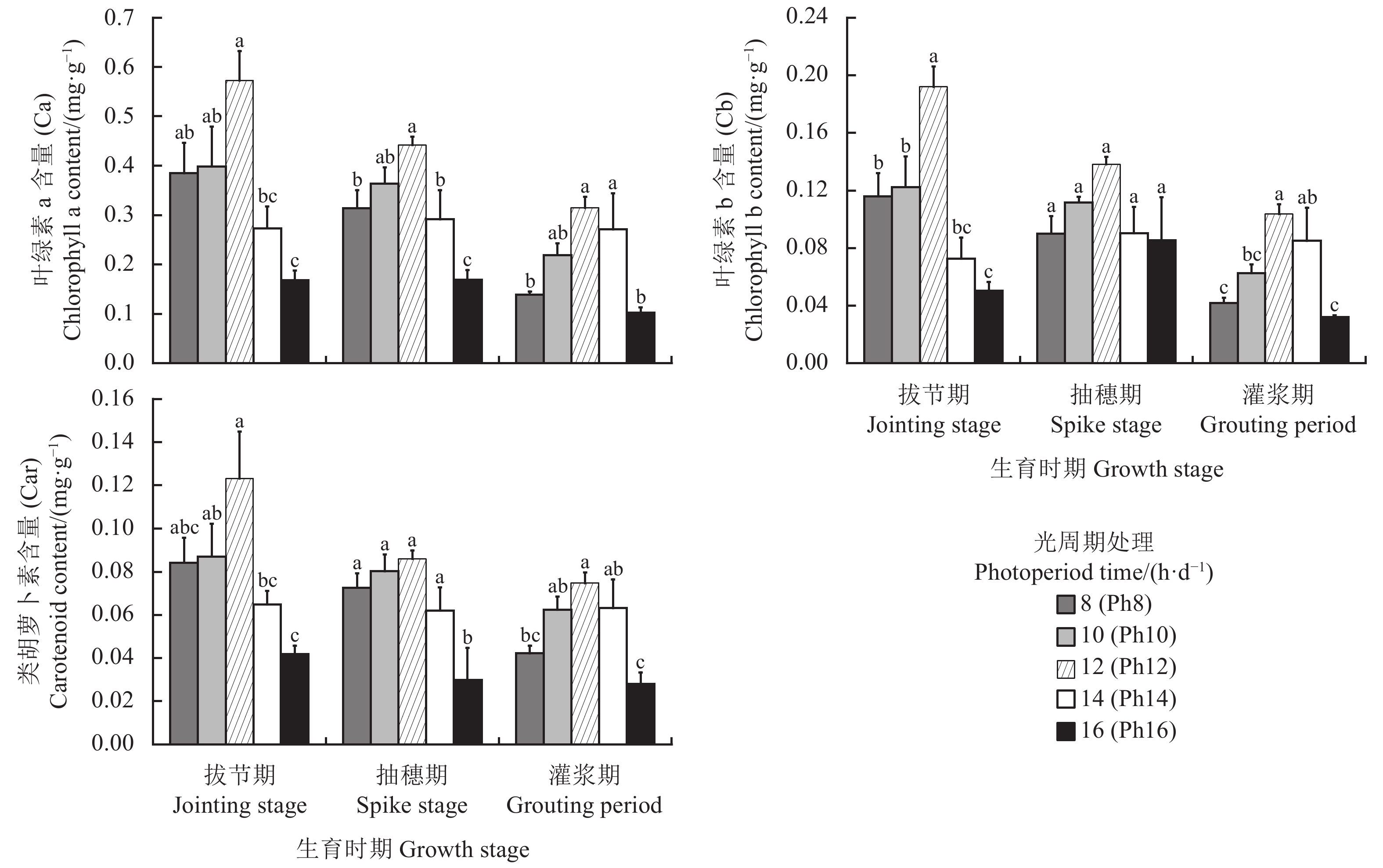
叶绿素作为植物进行光合作用的重要色素,其含量高低直接影响植物的光合作用,还可作为衡量叶片衰老的重要生理指标,在一定程度上也能够反映植株的代谢能力和抗逆性[17]。随生育时期的不断推进,叶绿素b (Cb)含量在P14和P16处理下呈先升后降的趋势,在其他处理下均呈下降趋势(图4),说明作物随着生育期的不断推进,植株叶片的光合色素含量整体将逐渐下降。因此,宁夏无芒稗在各生育时期的叶绿素含量表现为拔节期 > 抽穗期 > 灌浆期。随着光照时间的增加,宁夏无芒稗各生育期的叶绿素a、叶绿素b和类胡萝卜素含量呈“先升后降”的变化趋势,均在Ph12处理下达到最大。说明光照时间较短或较长可能导致植株叶片的叶绿素合成不足或抑制其合成。
2.3.4 光合参数
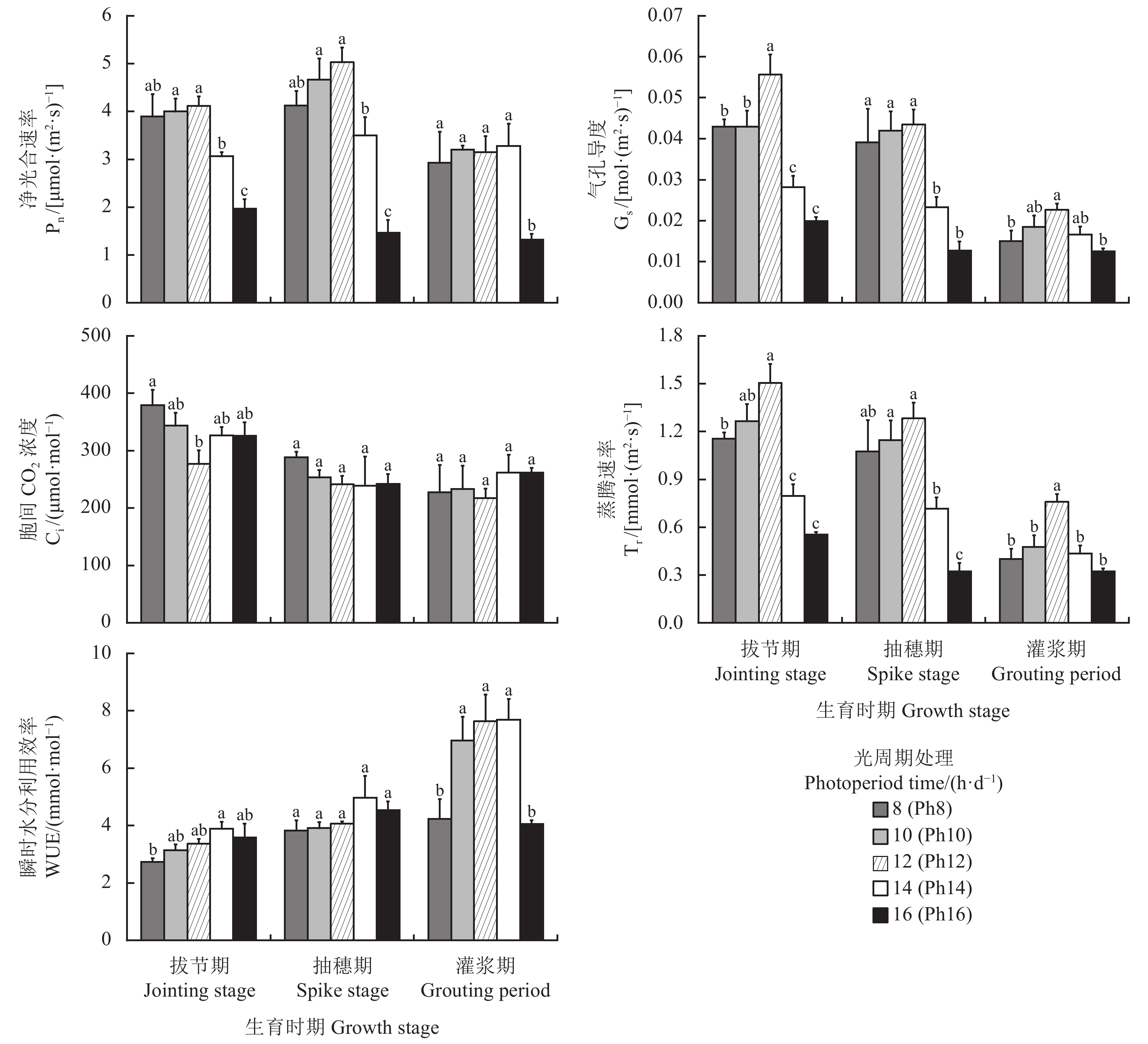
光合作用是植物生长发育的基础,也是植物对环境变化最为敏感的生理反应之一。不同光周期处理下,宁夏无芒稗在各生育期的光合参数发生变化(图5)。随着光照时间的延长,宁夏无芒稗各生育期的净光合速率整体呈“先升后降”的变化趋势,均在Ph16处理下显著低于其他处理(P < 0.05) (图5)。可能是长日照条件下,宁夏无芒稗的叶片严重卷曲,不利于植物进行光合作用,进而导致其净光合速率下降。且气孔导度和瞬时水分利用效率也呈“倒V”型变化过程,蒸腾速率也出现类似规律,在Ph16处理下宁夏无芒稗的蒸腾速率显著低于Ph12处理(P < 0.05),分别降低了63.27%、74.85%和57.45%。
2.4 光周期处理下宁夏无芒稗不同指标间的相关性
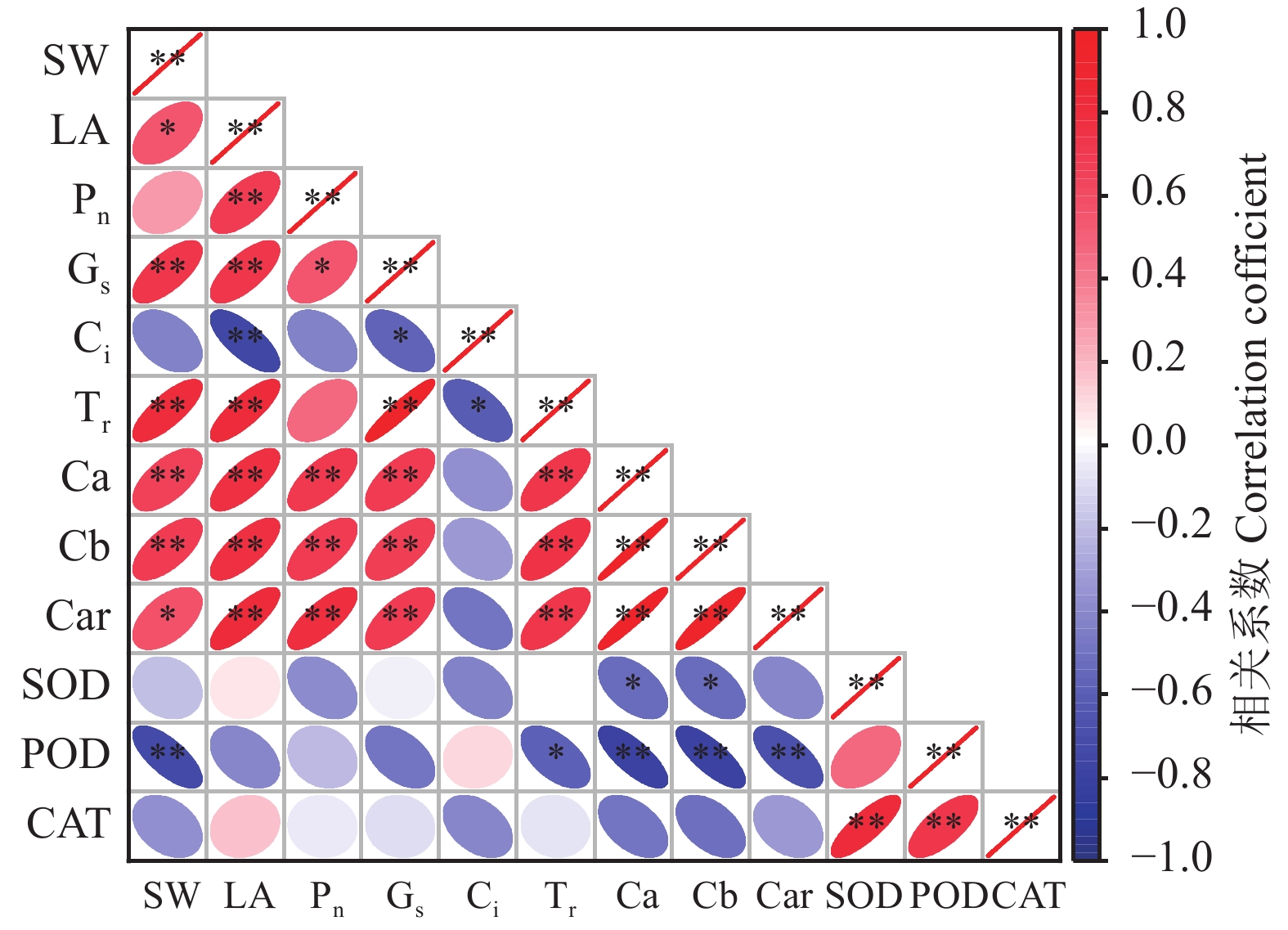
如图6所示,穗重(SW)和旗叶面积(LA)、Car呈显著正相关关系(P < 0.05),与Gs、Tr、Ca、Cb呈极显著正相关关系(P < 0.01),而与Pn呈正相关关系;反之,SW和3种抗氧化酶呈负相关关系。LA与Pn、Gs、Tr、Ca、Cb、Car之间呈极显著正相关关系(P < 0.01)。Pn与Ca、Cb、Car之间呈极显著正相关关系(P < 0.01),而与Ci、SOD、POD、CAT呈负相关关系。SOD与CAT呈极显著正相关关系(P < 0.01),而与POD呈正相关关系。通过对各指标的相关性分析发现,穗重与旗叶面积、光合、叶绿素含量等具有明显的相关性,说明叶绿素含量、光合等参数能够反映旗叶面积的大小,而旗叶面积又能够决定宁夏无芒稗种子产量的高低。
![]() 图 6 光周期处理下宁夏无芒稗各指标的相关性SW为穗重,LA为旗叶面积,Pn为净光合速率,Gs为气孔导度,Ci为胞间CO2浓度,Tr为蒸腾速率,Ca为叶绿素a含量,Cb为叶绿素b含量,Car为类胡萝卜素含量,SOD为超氧化物歧化酶,POD为过氧化物酶,CAT为过氧化氢酶;“*” 和“**”分别表示在0.05和0.01水平显著相关。Figure 6. Correlation of the indices of Echinochloa crusgalli under photoperiodic treatmentSW is spike weight, LA is area of flag leaf, Pn is net photosynthetic rate, Gs is stomatal conduction, Ci is intercellular CO2 concentration, Tr is transpiration rate, Ca is chlorophyll a content, Cb is chlorophyll b content, Car is carotenoid content, SOD is superoxide dismutase activity, POD is peroxidase activity, CAT is catalase activity; “*” and “**” indicate significant correlation at 0.05 and 0.01 levels, respectively.
图 6 光周期处理下宁夏无芒稗各指标的相关性SW为穗重,LA为旗叶面积,Pn为净光合速率,Gs为气孔导度,Ci为胞间CO2浓度,Tr为蒸腾速率,Ca为叶绿素a含量,Cb为叶绿素b含量,Car为类胡萝卜素含量,SOD为超氧化物歧化酶,POD为过氧化物酶,CAT为过氧化氢酶;“*” 和“**”分别表示在0.05和0.01水平显著相关。Figure 6. Correlation of the indices of Echinochloa crusgalli under photoperiodic treatmentSW is spike weight, LA is area of flag leaf, Pn is net photosynthetic rate, Gs is stomatal conduction, Ci is intercellular CO2 concentration, Tr is transpiration rate, Ca is chlorophyll a content, Cb is chlorophyll b content, Car is carotenoid content, SOD is superoxide dismutase activity, POD is peroxidase activity, CAT is catalase activity; “*” and “**” indicate significant correlation at 0.05 and 0.01 levels, respectively.3. 讨论与结论
光周期通过调控植物的生长发育进程,进而影响植物的产量和品质。本研究表明,随着光照时间的延长,宁夏无芒稗的整个生育期长短发生显著的变化。在长日照(16 h·d−1)条件下,宁夏无芒稗的生育期显著延长,生长缓慢。这与谢丽莉等[18]对玉米(Zea mays)和狗尾草(Setaria viridis)的光周期敏感性研究中结论相一致。这一发现表明过长的光照时间将延长宁夏无芒稗的生育期,可能会限制种子的发育或使植株不能避免恶劣的自然环境,并不利于牧草的生长发育。另外,光周期通过调控牧草的生长指标,进而影响牧草的产量[19]。本研究发现,宁夏无芒稗各生育期的株高均随着光照时间的延长呈不断上升的趋势,而茎粗和叶片数均呈先升后降的变化趋势,这与王玉卓等[20]的研究结果基本一致,说明适当延长光照时间有利于植物的生长。此外,还有研究表明,旗叶性状是抽穗开花至成熟期影响籽粒产量的重要因素[21]。本研究发现,随着光照时间延长,旗叶各性状均呈先升后降的趋势,与之相同,籽粒产量也呈现相似的变化规律,造成该现象的原因可能是光照时间太短或太长使得旗叶面积小且卷曲严重,不利于旗叶进行的光合,从而造成籽粒产量较低。但是发现随光照时间的延长,宁夏无芒稗各生育期的地上生物量则呈上升趋势,这与前人研究结果一致[22],该现象的可能原因是随着光照时间的延长,宁夏无芒稗的营养生长期显著延长,有利于植株干物质的积累。
当外界环境变化时,植物能够通过调节抗氧化酶活性及渗透调节物质含量以此来适应环境的变化[23]。已有研究表明,在光胁迫下植物体内的抗氧化酶能够减轻光胁迫对植株的伤害,其中SOD主要作用是清除超氧物阴离子自由基,CAT和POD的作用是清除细胞内过多的过氧化物,是活性氧清除酶系统的重要保护酶,能够有效清除自由基氧化损伤[24]。本研究发现,随着光照时间的延长,宁夏无芒稗各生育期的SOD、CAT和POD活性均呈先降后升的趋势,造成该现象的原因可能是中等日照长度下,宁夏无芒稗叶片的超氧阴离子自由基的产生和清除处于动态平衡,所以不同程度地降低了3种酶的活性;相反,光照时间太短或太长会刺激宁夏无芒稗叶片3种酶活性的升高,以此清除植株细胞内多余的活性氧,减轻对植株叶片的伤害,以确保植株光合作用持续正常的进行。这与赵宝平等[25]关于光周期对燕麦(Avena nuda)影响的研究结果相似。
另外,叶绿素不仅在一定程度上反映植物的光合能力,而且还能反映植物的生长情况[26]。光照时间的变化可影响植物体内叶绿素的含量。本研究表明,随着生育期的推进,叶绿素a和类胡萝卜素含量均呈下降趋势,可能是随着生育期的推进,叶片逐渐黄化衰老,进而导致宁夏无芒稗叶片的叶绿素含量逐渐降低[27]。此外,随着光照时间的延长,宁夏无芒稗各生育期的光合色素含量均呈先升后降的变化趋势,在Ph12处理下其叶绿素含量最高。由此说明适当延长光照时间有利于宁夏无芒稗叶片光合色素的积累,使叶片增绿。造成该现象的原因,可能是短日照限制植株的光合碳同化和光合酶等活力,进而抑制了叶绿素的合成,或延续的过长日照下,植株的光合产物达到饱和后将产生负反馈作用,进而抑制叶片中叶绿素的合成,使得叶片中叶绿素含量降低[28-29]。这与韦朝妹等[30]关于补光时长对多肉‘艳日辉’(Aeonium decorum f. variegata)形态及生理影响的研究结论一致。
光合作用是植物通过叶片中叶绿素将光能进行吸收传递最终转变成化学能的过程,植物体内叶绿素含量的多少直接影响植物的光合速率等[31]。此外,光周期对植物光合参数的影响受生育期等影响较大[3]。已有研究发现,造成植物光合速率降低有两种限制因素:一是气孔关闭导致的气孔限制因素;二是光合色素的降解及合成受阻等造成的非气孔限制因素[32]。本研究发现,随着生育时期的推进,宁夏无芒稗的光合参数呈下降趋势。这可能是随着生育期推进,宁夏无芒稗叶片的叶绿素含量下降,从而使得光合速率减弱。同时,随着光照时间的延长,宁夏无芒稗各生育期的Pn、Gs、Tr和WUE整体呈“倒V”型变化过程,Ci则呈先降后升的变化趋势。因此,宁夏无芒稗的Pn下降可能是受非气孔限制因素的影响。李孟洋等[33]关于缩短光周期对茅苍术(Atractylodes lancea)影响的研究中也发现了类似的现象。该现象的潜在机制可能是不利的光照条件使植株体内产生较多的活性氧,进而对植株的光合作用结构和功能造成损伤;也可能是短日照使得植株叶绿素合成不足,而长日照抑制叶绿素的合成,导致植株的Pn下降。这一发现说明太长或太短的日照时间均不利于宁夏无芒稗的光合作用,从而影响其正常的生长发育,该现象的机制可能是,适当延长光照时间,使植株进行光合作用的时间增加,合成积累更多的有机物以支持宁夏无芒稗的生长发育,反之较短的光照时间会降低有机物的合成,不利于植株的生长发育。
综上所述,本研究通过分析不同光周期对宁夏无芒稗拔节期、抽穗期和灌浆期3个生育时期的生长和生理生化指标的影响。结果表明中等日照长度(12 h·d−1)条件下是宁夏无芒稗生长发育的适宜光照条件;而在长日照(16 h·d−1)下,宁夏无芒稗的生育期显著延长,生长缓慢。其潜在的调控机制是:1)适当延长光照时间有利于叶片中光合色素的积累,从而增强了宁夏无芒稗叶片对光能的传递和利用效率,提高光合效率,合成积累更多的光合产物。2)适宜延长光照时间下,植株通过抗氧化酶系统及时清除多余的活性氧,以维持体内自由基代谢的动态平衡,进而保护植株膜系统的稳定性,有利于植株的光合作用。值得注意的是,本研究设置在人工气候室中进行,削弱了其他环境因子对植物生长发育的影响,因而结果具有一定的局限性。因此,在未来的研究中需要通过田间试验进一步研究和验证,明确其适宜的光照长度,为其合理引种提高科学依据,以避免不适宜地区引种种植后其产量及品质下降,严重制约区域土地资源合理利用,从而造成土地和牧草资源浪费等问题。
参考文献
[1] SILVA C S, SEIDER W D, LIOR N. Exergy efficiency of plant photosynthesis. Chemical Engineering Science, 2015, 130: 151-171. doi: 10.1016/j.ces.2015.02.011
[2] JOHANSSON M, STAIGER D. Time to flower: Interplay between photoperiod and the circadian clock. Journal of Experimental Botany, 2015, 66(3): 719-730. doi: 10.1093/jxb/eru441
[3] 杨振超, 何蔚, 牟孙涛, 王晓旭, 陈丹艳, 胡晓婷, 陈乐涵, 白晶雨. 不同光周期和红蓝光质配比对辣椒幼苗生长发育的影响. 农业工程学报, 2017, 33(17): 173-180. doi: 10.11975/j.issn.1002-6819.2017.17.023 YANG Z C, HE W, MOU S T, WANG X X, CHEN D Y, HU X T, CHEN L H, BAI J Y. Plant growth and development of pepper seedlings under different photoperiods and photon flux ratios of red and blue LEDs. Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(17): 173-180. doi: 10.11975/j.issn.1002-6819.2017.17.023
[4] MACIOSZE V K, SOBCZAK M, SKOCZOWSKI A, OLIWA J, MICHLEWSK S, MAGDALENA G, CIERESZKO I, KONONOWICZ A K. The effect of photoperiod on necrosis development, photosynthetic efficiency and ‘Green Islands’ formation in Brassica juncea infected with Alternaria brassicicola. International Journal of Molecular Sciences, 2021, 22(16): 8435. doi: 10.3390/ijms22168435
[5] ZENG J, SHENG H J, LIU Y, WANG Y, WANG Y, KANG H Y, FAN X, SHA L, YUAN S, ZHOU Y H. High nitrogen supply induces physiological responsiveness to long photoperiod in barley. Frontiers in Plant Science, 2017, 8: 569.
[6] WAKE C M F, FENNELL A. Morphological, physiological and dormancy responses of three Vitis genotypes to short photoperiod. Physiology Plantarum, 2000, 109(2): 203-210. doi: 10.1034/j.1399-3054.2000.100213.x
[7] KIM T N, KIM B N, VON ARNIM A G. Repressors of photomorphogenesis. International Review of Cytology, 2002, 220: 185-223.
[8] LEGNANI G, MILLER W B. Short photoperiods induce fructan accumulation and tuberous root development in Dahlia seedlings. New Phytologist, 2001, 149(3): 449-454. doi: 10.1046/j.1469-8137.2001.00055.x
[9] BERNIER G. The control of floral evocation and morphogenesis. Annual Review of Plant Physiology and Plant Molecular Biology, 1988, 39(1): 175-219. doi: 10.1146/annurev.pp.39.060188.001135
[10] 陆思宇, 杨再强, 杨立, 张源达, 郑涵. 不同光周期对菊花生长发育及内源激素的影响. 华北农学报, 2021, 36(6): 106-115. doi: 10.7668/hbnxb.20192386 LU S Y, YANG Z Q, YANG L, ZAHNG Y D, ZHENG H. Effects of different photoperiods on the growth and development process and endogenous hormines of chrysanthemum. Acta Agriculturae Boreali-Sinica, 2021, 36(6): 106-115. doi: 10.7668/hbnxb.20192386
[11] 史莹华, 王成章, 张伟毅, 王先科. 苜蓿秋眠型与其超氧化物歧化酶和过氧化物酶关系的研究. 草业科学, 2009, 26(8): 128-131. doi: 10.3969/j.issn.1001-0629.2009.08.023 SHI Y H, WANG C Z, ZHANG W Y, WANG X K. Relationship between the fall dormancy of alfalfa and activities of SOD and POD. Pratacultural Science, 2009, 26(8): 128-131. doi: 10.3969/j.issn.1001-0629.2009.08.023
[12] 吴素琴. 驯化草种: 宁夏无芒稗. 宁夏农林科技, 2001(4): 34, 17. WU S Q. Domesticated grass species: Echinochloa crusgalli var. mitis. Ningxia Journal of Agriculture and Forestry Science and Technology, 2001(4): 34, 17.
[13] 兰艳, 朱林, 王甜甜, 荆庆芳, 张杨, 赵学琳. 混合盐碱胁迫对3种稗属牧草种子萌发的影响. 种子, 2022, 41(3): 37-44. doi: 10.16590/j.cnki.1001-4705.2022.03.037 LAN Y, ZHU L, WANG T T, JING Q F, ZHANG Y, ZHAO X L. Effects of mixed saline-alkali stress on germination od three kinds of Echinochloa grass. Seed, 2022, 41(3): 37-44. doi: 10.16590/j.cnki.1001-4705.2022.03.037
[14] 杨迎月, 毛桂莲, 麻冬梅, 张峰举, 许兴. 四种牧草种子在不同浓度NaCl或NaHCO3胁迫下的萌发特性. 草地学报, 2022, 30(3): 637-645. YANG Y Y, MAO G L, MA D M, ZHANG F J, XU X. Germination characteristics of four forage seeds under different concentrations of NaCl or NaHCO3 stress. Acta Agrestia Sinica, 2022, 30(3): 637-645.
[15] 石秀兰, 陈云鹏. 湖南稷子在内蒙地区的种植试验. 内蒙古草业, 1994(3/4): 64-65. SHI X L, CHEN Y P. Planting trials of Echinochloa frumentacea in Inner Mongolia. Grassland and Prataculture, 1994(3/4): 64-65.
[16] 潘瑞炽. 植物生理学. 北京: 高等教育出版社, 2012. PAN R Z. Plant Physiology. Beijing: Higher Education Press, 2012.
[17] 杜志伟, 杨肖松, 刘月仙, 解小凡, 张瑞丽, 张萌, 王伟. 有机污染物芘胁迫下白菜生理特性变化规律. 生态学报, 2021, 41(3): 998-1005. DU Z Q, YANG X S, LIU Y X, XIE X F, ZHANG R L, ZHANG M, WANG W. Analysis of physiological characteristics of Chinese cabbages under pyrene stress. Acta Ecologica Sinica, 2021, 41(3): 998-1005.
[18] 谢丽莉, 吴连成, 库丽霞, 吴刘记, 张君, 王新涛, 陈彦惠. 玉米和狗尾草光周期敏感性的比较研究. 玉米科学, 2012, 20(2): 82-86. doi: 10.3969/j.issn.1005-0906.2012.02.016 XIE L L, WU L C, KU L X, WU L J, ZHANG J, WANG X T, CHEN Y H. Comparative study on the photoperiod-sensitive between maize and Setaria viridis. Journal of Maize Sciences, 2012, 20(2): 82-86. doi: 10.3969/j.issn.1005-0906.2012.02.016
[19] 王建平, 王纪章, 周静, 贺通, 李萍萍. 光照对农林植物生长影响及人工补光技术研究进展. 南京林业大学学报(自然科学版), 2020, 44(1): 215-222. WANG J P, WANG J Z, ZHOU J, HE T, LI P P. Recent progress of artificial lighting technique and effect of light on plant growth. Journal of Nanjing Forestry University (Natural Sciences Edition), 2020, 44(1): 215-222.
[20] 王玉卓, 谷巍, 巢建国, 盛业龙, 夏蕴, 王圆圆, 惠西珂. 不同光周期对茅苍术营养生长期生长及生理生化指标的影响. 南方农业学报, 2019, 50(12): 2673-2679. doi: 10.3969/j.issn.2095-1191.2019.12.07 WANG Y Z, GU W, CHAO J G, SHENG Y L, XIA Y, WANG Y Y, HUI X K. Effects of different photoperiods on the growth and some physiological and biochemical indexes of Atractylodes lancea (Thunb.) DC. during vegetative growth. Journal of Southern Agriculture, 2019, 50(12): 2673-2679. doi: 10.3969/j.issn.2095-1191.2019.12.07
[21] 吴金芝, 黄明, 王志敏, 李友军, 张振旺, 王贺正, 付国占, 陈明灿. 干旱对冬小麦旗叶光合参数、产量和水分利用效率的影响. 江苏农业学报, 2021, 37(5): 1108-1118. doi: 10.3969/j.issn.1000-4440.2021.05.003 WU J Z, HUANG M, WANG Z M, LI Y J, ZHANG Z W, WANG H Z, FU G Z, CHEN M C. Effects of drought on flag leaf photosynthetic parameters, grain yield and water use efficiency in winter wheat. Jiangsu Journal of Agricultural Sciences, 2021, 37(5): 1108-1118. doi: 10.3969/j.issn.1000-4440.2021.05.003
[22] 陈晓仪, 杨千叶, 赵琦. 不同光周期对浮萍生长及淀粉积累的影响. 北方园艺, 2017(22): 50-54. CHEN X Y, YANG Q Y, ZHAO Q. Effect of different photoperiod on the growth and starch accumulation of duckweed. Northern Horticulture, 2017(22): 50-54.
[23] 杨舒贻, 陈晓阳, 惠文凯, 任颖, 马玲. 逆境胁迫下植物抗氧化酶系统响应研究进展. 福建农林大学学报(自然科学版), 2016, 45(5): 481-489. doi: 10.13323/j.cnki.j.fafu(nat.sci.).2016.05.001 YANG S Y, CHEN X Y, HUI W K, REN Y, MA L. Progress in responses of antioxidant enzyme systems in plant to environmental stresses. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2016, 45(5): 481-489. doi: 10.13323/j.cnki.j.fafu(nat.sci.).2016.05.001
[24] 冼康华, 苏江, 黄宁珍, 何金祥, 付传明. 光调控对金线莲生长发育的影响. 广西科学院学报, 2019, 35(1): 36-44. doi: 10.13657/j.cnki.gxkxyxb.20190123.003 XIAN K H, SU J, HUANG N Z, HE J X, FU C M. Effect of light environmental control on the growth and development of Anoectochilus roxburghii. Journal of Guangxi Academy of Sciences, 2019, 35(1): 36-44. doi: 10.13657/j.cnki.gxkxyxb.20190123.003
[25] 赵宝平, 张娜, 任长忠, 刘景辉, 莫非. 光周期对燕麦生育时期和穗分化的影响. 生态学报, 2011, 31(9): 2492-2500. ZHAO B P, ZHANG N, REN C Z, LIU J H, MO F. Ecophysiological mechanism of photoperiod affecting phenological period and spike differentiation in oat (Avena nuda L.). Acta Ecologica Sinica, 2011, 31(9): 2492-2500.
[26] GHOTBI-RAVANDI A A, SHAHBAZI M, SHARIATI M, MULO P. Effects of mild and severe drought stress on photosynthetic efficiency in tolerant and susceptible barley (Hordeum vulgare L.) genotypes. Journal of Agronomy and Crop Science, 2014, 200(6): 403-415. doi: 10.1111/jac.12062
[27] 罗远华, 王振波, 黄敏玲, 钟淮钦. 文心兰不同生育期茎叶生理指标的动态变化. 福建农业学报, 2017, 32(7): 719-723. doi: 10.19303/j.issn.1008-0384.2017.07.006 LUO Y H, WANG Z B, HUANG M L, ZHONG H Q. Physiological indices on top-leaves and pseudo-bulbs of Oncidium at different growth stages. Fujian Journal of Agricultural Sciences, 2017, 32(7): 719-723. doi: 10.19303/j.issn.1008-0384.2017.07.006
[28] 王峰, 闫家榕, 陈雪玉, 姜程浩, 孟思达, 刘玉凤, 许涛, 齐明芳, 李天来. 光调控植物叶绿素生物合成的研究进展. 园艺学报, 2019, 46(5): 975-994. doi: 10.16420/j.issn.0513-353x.2018-0799 WANG F, YAN J R, CHEN X Y, JIANG C H, MENG S D, LIU Y F, XU T, QI M F, LI T L. Light regulation of chlorophyll biosynthesis in plants. Acta Horticulturae Sinica, 2019, 46(5): 975-994. doi: 10.16420/j.issn.0513-353x.2018-0799
[29] 何俊俊, 杨京平, 杨虎, 赵杏, 叶欣怡. 光照及氮素水平对水稻冠层叶片SPAD值动态变化的影响. 浙江大学学报(农业与生命科学版), 2014, 40(5): 495-504. HE J J, YANG J P, YANG H, ZHAO X, YE X Y. Effects of light intensity and nitrogen supply on the dynamic characteristics of leaf SPAD value of rice canopy. Journal of Zhejiang University (Agriculture and Life Sciences), 2014, 40(5): 495-504.
[30] 韦朝妹, 胡小京, 李晓慧, 冉旭. 不同LED补光时长对多肉‘艳日辉’形态及生理的影响. 分子植物育种, 2023, 21(7): 2356-2364. WEI C M, HU X J, LI X H, RAN X. Effect of different LED supplemental time on the morphology and physiology of Aeonium decorum f. variegata. Molecular Plant Breeding, 2023, 21(7): 2356-2364.
[31] 张瑞洁, 贺忠群, 李春燕, 莫建超, 谢永东. 植物工厂中光周期对番杏光合特性及品质的影响. 应用与环境生物学报, 2022, 28(4): 989-994. doi: 10.19675/j.cnki.1006-687x.2021.11017 ZHANG R J, HE Z Q, LI C Y, MO J C, XIE Y D. Effects of photoperiod on photosynthetic characteristics and quality of Tetyagonia tetragonoides (Pall.) Kuntze in a plant factory. Chinese Journal of Applied and Environmental Biology, 2022, 28(4): 989-994. doi: 10.19675/j.cnki.1006-687x.2021.11017
[32] 严加坤, 张宁宁, 张岁岐. 谷子对干旱胁迫的生理生态响应. 生态学报, 2021, 41(21): 8612-8622. YAN J K, ZHANG N N, ZHANG S Q. Physiological and ecological responses of foxtail millet to drought stress. Acta Ecologica Sinica, 2021, 41(21): 8612-8622.
[33] 李孟洋, 韩怡, 王玉卓. 缩短光周期对茅苍术生理生化指标的影响. 北方园艺, 2021(14): 122-127. LI M Y, HAN Y, WANG Y Z. Effects of shortening the photoperiod on physiological biochemistry index of Atractylodes lancea. Northern Horticulture, 2021(14): 122-127.
-
图 6 光周期处理下宁夏无芒稗各指标的相关性
SW为穗重,LA为旗叶面积,Pn为净光合速率,Gs为气孔导度,Ci为胞间CO2浓度,Tr为蒸腾速率,Ca为叶绿素a含量,Cb为叶绿素b含量,Car为类胡萝卜素含量,SOD为超氧化物歧化酶,POD为过氧化物酶,CAT为过氧化氢酶;“*” 和“**”分别表示在0.05和0.01水平显著相关。
Figure 6. Correlation of the indices of Echinochloa crusgalli under photoperiodic treatment
SW is spike weight, LA is area of flag leaf, Pn is net photosynthetic rate, Gs is stomatal conduction, Ci is intercellular CO2 concentration, Tr is transpiration rate, Ca is chlorophyll a content, Cb is chlorophyll b content, Car is carotenoid content, SOD is superoxide dismutase activity, POD is peroxidase activity, CAT is catalase activity; “*” and “**” indicate significant correlation at 0.05 and 0.01 levels, respectively.
表 1 不同生育时期和光周期对宁夏无芒稗生长指标的影响
Table 1 Effects of different fertility periods and photoperiods on the growth index of Echinochloa crusgalli
生育时期
Fertility period光周期处理
Photoperiod time/(h·d−1)株高
Plant height/cm茎粗
Stem diameter/mm叶长
Leaf length/cm叶片数
Leaf number地上生物量
Aboveground biomass/g拔节期
Jointing stage8 (Ph8) 36.67 ± 0.29c 2.61 ± 0.09c 18.73 ± 0.13d 3.47 ± 0.07ab 0.31 ± 0.02e 10 (Ph10) 37.60 ± 0.61bc 3.30 ± 0.18b 20.87 ± 0.47c 3.53 ± 0.13ab 0.38 ± 0.01d 12 (Ph12) 38.20 ± 0.35b 3.96 ± 0.12a 21.53 ± 0.13c 3.73 ± 0.18a 0.52 ± 0.01c 14 (Ph14) 38.93 ± 0.29b 3.61 ± 0.17ab 23.13 ± 0.77b 3.53 ± 0.07ab 0.61 ± 0.01b 16 (Ph16) 49.13 ± 0.47a 3.59 ± 0.04ab 25.40 ± 0.58a 3.20 ± 0.12b 0.84 ± 0.03a 抽穗期
Spike stage8 (Ph8) 39.13 ± 0.44b 2.86 ± 0.21c 20.60 ± 0.31c 3.60 ± 0.12b 0.58 ± 0.02d 10 (Ph10) 39.27 ± 0.24b 3.49 ± 0.11b 21.13 ± 1.00bc 3.67 ± 0.18b 0.62 ± 0.02d 12 (Ph12) 39.73 ± 0.98b 4.19 ± 0.10a 21.73 ± 0.41bc 4.07 ± 0.07a 0.72 ± 0.02c 14 (Ph14) 41.73 ± 0.07b 4.08 ± 0.08a 24.67 ± 0.68b 3.60 ± 0.12b 0.99 ± 0.03b 16 (Ph16) 52.13 ± 1.40a 3.92 ± 0.13a 28.87 ± 0.18a 3.33 ± 0.07b 1.09 ± 0.00a 灌浆期
Grouting stage8 (Ph8) 40.47 ± 0.48c 3.09 ± 0.24d 20.93 ± 0.18c 3.67 ± 0.24b 0.61 ± 0.04d 10 (Ph10) 40.93 ± 0.93bc 3.50 ± 0.20cd 22.33 ± 0.73bc 3.93 ± 0.07b 0.81 ± 0.01c 12 (Ph12) 42.07 ± 0.18bc 5.64 ± 0.21a 22.53 ± 0.81bc 4.53 ± 0.24a 0.87 ± 0.03c 14 (Ph14) 42.47 ± 0.47b 5.00 ± 0.11b 25.40 ± 1.90b 4.13 ± 0.07ab 1.04 ± 0.05b 16 (Ph16) 53.40 ± 0.53a 4.01 ± 0.14c 30.87 ± 0.47a 3.67 ± 0.07b 1.17 ± 0.01a 生育时期 Period of fertility 47.53** 38.54** 14.62** 17.82** 280.28** 光周期 Photoperiod 226.61** 59.29** 60.11** 11.67** 211.14** 生育时期 × 光周期
Period of fertility × photoperiod0.40 5.90** 1.65 0.88 3.39** 不同小写字母表示同一生育期不同光周期处理间差异显著(P < 0.05),**表示具有极显著影响(P < 0.01);下同。
Different lowercase letters for the same fertility period indicate significant differences between different photoperiod treatments at the 0.05 level; ** indicates an extremely significant difference at the 0.01 level; This is applicable for the following figures and tables as well.表 2 光周期处理下宁夏无芒稗生长指标的比较
Table 2 Comparison of growth indices of Echinochloa crusgalli under photoperiodic treatment
光周期
Photoperiod time/
(h·d−1)旗叶叶长
Length of flag leaf/
mm旗叶叶宽
Width of flag leaf/
mm旗叶面积
Area of flag leaf/
mm2穗长
Spike length/
cm穗宽
Spike width/
cm穗重
Spike weight/
g8 (Ph8) 50.99 ± 0.32c 7.42 ± 0.33ab 329.96 ± 1.32b 3.01 ± 0.04a 0.81 ± 0.02abc 0.40 ± 0.05b 10 (Ph10) 53.37 ± 0.56b 7.76 ± 0.41a 338.05 ± 5.37b 3.12 ± 0.10a 0.84 ± 0.05ab 0.45 ± 0.03b 12 (Ph12) 67.26 ± 0.13a 8.42 ± 0.26a 458.09 ± 3.09a 3.14 ± 0.17a 3.96 ± 0.12a 0.67 ± 0.04a 14 (Ph14) 48.09 ± 0.69d 7.52 ± 0.41ab 291.99 ± 2.65c 3.00 ± 0.06a 3.61 ± 0.17ab 0.50 ± 0.04b 16 (Ph16) 38.07 ± 0.47e 6.41 ± 0.26b 198.66 ± 3.72d 2.83 ± 0.07a 3.59 ± 0.04ab 0.46 ± 0.05b -
[1] SILVA C S, SEIDER W D, LIOR N. Exergy efficiency of plant photosynthesis. Chemical Engineering Science, 2015, 130: 151-171. doi: 10.1016/j.ces.2015.02.011
[2] JOHANSSON M, STAIGER D. Time to flower: Interplay between photoperiod and the circadian clock. Journal of Experimental Botany, 2015, 66(3): 719-730. doi: 10.1093/jxb/eru441
[3] 杨振超, 何蔚, 牟孙涛, 王晓旭, 陈丹艳, 胡晓婷, 陈乐涵, 白晶雨. 不同光周期和红蓝光质配比对辣椒幼苗生长发育的影响. 农业工程学报, 2017, 33(17): 173-180. doi: 10.11975/j.issn.1002-6819.2017.17.023 YANG Z C, HE W, MOU S T, WANG X X, CHEN D Y, HU X T, CHEN L H, BAI J Y. Plant growth and development of pepper seedlings under different photoperiods and photon flux ratios of red and blue LEDs. Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(17): 173-180. doi: 10.11975/j.issn.1002-6819.2017.17.023
[4] MACIOSZE V K, SOBCZAK M, SKOCZOWSKI A, OLIWA J, MICHLEWSK S, MAGDALENA G, CIERESZKO I, KONONOWICZ A K. The effect of photoperiod on necrosis development, photosynthetic efficiency and ‘Green Islands’ formation in Brassica juncea infected with Alternaria brassicicola. International Journal of Molecular Sciences, 2021, 22(16): 8435. doi: 10.3390/ijms22168435
[5] ZENG J, SHENG H J, LIU Y, WANG Y, WANG Y, KANG H Y, FAN X, SHA L, YUAN S, ZHOU Y H. High nitrogen supply induces physiological responsiveness to long photoperiod in barley. Frontiers in Plant Science, 2017, 8: 569.
[6] WAKE C M F, FENNELL A. Morphological, physiological and dormancy responses of three Vitis genotypes to short photoperiod. Physiology Plantarum, 2000, 109(2): 203-210. doi: 10.1034/j.1399-3054.2000.100213.x
[7] KIM T N, KIM B N, VON ARNIM A G. Repressors of photomorphogenesis. International Review of Cytology, 2002, 220: 185-223.
[8] LEGNANI G, MILLER W B. Short photoperiods induce fructan accumulation and tuberous root development in Dahlia seedlings. New Phytologist, 2001, 149(3): 449-454. doi: 10.1046/j.1469-8137.2001.00055.x
[9] BERNIER G. The control of floral evocation and morphogenesis. Annual Review of Plant Physiology and Plant Molecular Biology, 1988, 39(1): 175-219. doi: 10.1146/annurev.pp.39.060188.001135
[10] 陆思宇, 杨再强, 杨立, 张源达, 郑涵. 不同光周期对菊花生长发育及内源激素的影响. 华北农学报, 2021, 36(6): 106-115. doi: 10.7668/hbnxb.20192386 LU S Y, YANG Z Q, YANG L, ZAHNG Y D, ZHENG H. Effects of different photoperiods on the growth and development process and endogenous hormines of chrysanthemum. Acta Agriculturae Boreali-Sinica, 2021, 36(6): 106-115. doi: 10.7668/hbnxb.20192386
[11] 史莹华, 王成章, 张伟毅, 王先科. 苜蓿秋眠型与其超氧化物歧化酶和过氧化物酶关系的研究. 草业科学, 2009, 26(8): 128-131. doi: 10.3969/j.issn.1001-0629.2009.08.023 SHI Y H, WANG C Z, ZHANG W Y, WANG X K. Relationship between the fall dormancy of alfalfa and activities of SOD and POD. Pratacultural Science, 2009, 26(8): 128-131. doi: 10.3969/j.issn.1001-0629.2009.08.023
[12] 吴素琴. 驯化草种: 宁夏无芒稗. 宁夏农林科技, 2001(4): 34, 17. WU S Q. Domesticated grass species: Echinochloa crusgalli var. mitis. Ningxia Journal of Agriculture and Forestry Science and Technology, 2001(4): 34, 17.
[13] 兰艳, 朱林, 王甜甜, 荆庆芳, 张杨, 赵学琳. 混合盐碱胁迫对3种稗属牧草种子萌发的影响. 种子, 2022, 41(3): 37-44. doi: 10.16590/j.cnki.1001-4705.2022.03.037 LAN Y, ZHU L, WANG T T, JING Q F, ZHANG Y, ZHAO X L. Effects of mixed saline-alkali stress on germination od three kinds of Echinochloa grass. Seed, 2022, 41(3): 37-44. doi: 10.16590/j.cnki.1001-4705.2022.03.037
[14] 杨迎月, 毛桂莲, 麻冬梅, 张峰举, 许兴. 四种牧草种子在不同浓度NaCl或NaHCO3胁迫下的萌发特性. 草地学报, 2022, 30(3): 637-645. YANG Y Y, MAO G L, MA D M, ZHANG F J, XU X. Germination characteristics of four forage seeds under different concentrations of NaCl or NaHCO3 stress. Acta Agrestia Sinica, 2022, 30(3): 637-645.
[15] 石秀兰, 陈云鹏. 湖南稷子在内蒙地区的种植试验. 内蒙古草业, 1994(3/4): 64-65. SHI X L, CHEN Y P. Planting trials of Echinochloa frumentacea in Inner Mongolia. Grassland and Prataculture, 1994(3/4): 64-65.
[16] 潘瑞炽. 植物生理学. 北京: 高等教育出版社, 2012. PAN R Z. Plant Physiology. Beijing: Higher Education Press, 2012.
[17] 杜志伟, 杨肖松, 刘月仙, 解小凡, 张瑞丽, 张萌, 王伟. 有机污染物芘胁迫下白菜生理特性变化规律. 生态学报, 2021, 41(3): 998-1005. DU Z Q, YANG X S, LIU Y X, XIE X F, ZHANG R L, ZHANG M, WANG W. Analysis of physiological characteristics of Chinese cabbages under pyrene stress. Acta Ecologica Sinica, 2021, 41(3): 998-1005.
[18] 谢丽莉, 吴连成, 库丽霞, 吴刘记, 张君, 王新涛, 陈彦惠. 玉米和狗尾草光周期敏感性的比较研究. 玉米科学, 2012, 20(2): 82-86. doi: 10.3969/j.issn.1005-0906.2012.02.016 XIE L L, WU L C, KU L X, WU L J, ZHANG J, WANG X T, CHEN Y H. Comparative study on the photoperiod-sensitive between maize and Setaria viridis. Journal of Maize Sciences, 2012, 20(2): 82-86. doi: 10.3969/j.issn.1005-0906.2012.02.016
[19] 王建平, 王纪章, 周静, 贺通, 李萍萍. 光照对农林植物生长影响及人工补光技术研究进展. 南京林业大学学报(自然科学版), 2020, 44(1): 215-222. WANG J P, WANG J Z, ZHOU J, HE T, LI P P. Recent progress of artificial lighting technique and effect of light on plant growth. Journal of Nanjing Forestry University (Natural Sciences Edition), 2020, 44(1): 215-222.
[20] 王玉卓, 谷巍, 巢建国, 盛业龙, 夏蕴, 王圆圆, 惠西珂. 不同光周期对茅苍术营养生长期生长及生理生化指标的影响. 南方农业学报, 2019, 50(12): 2673-2679. doi: 10.3969/j.issn.2095-1191.2019.12.07 WANG Y Z, GU W, CHAO J G, SHENG Y L, XIA Y, WANG Y Y, HUI X K. Effects of different photoperiods on the growth and some physiological and biochemical indexes of Atractylodes lancea (Thunb.) DC. during vegetative growth. Journal of Southern Agriculture, 2019, 50(12): 2673-2679. doi: 10.3969/j.issn.2095-1191.2019.12.07
[21] 吴金芝, 黄明, 王志敏, 李友军, 张振旺, 王贺正, 付国占, 陈明灿. 干旱对冬小麦旗叶光合参数、产量和水分利用效率的影响. 江苏农业学报, 2021, 37(5): 1108-1118. doi: 10.3969/j.issn.1000-4440.2021.05.003 WU J Z, HUANG M, WANG Z M, LI Y J, ZHANG Z W, WANG H Z, FU G Z, CHEN M C. Effects of drought on flag leaf photosynthetic parameters, grain yield and water use efficiency in winter wheat. Jiangsu Journal of Agricultural Sciences, 2021, 37(5): 1108-1118. doi: 10.3969/j.issn.1000-4440.2021.05.003
[22] 陈晓仪, 杨千叶, 赵琦. 不同光周期对浮萍生长及淀粉积累的影响. 北方园艺, 2017(22): 50-54. CHEN X Y, YANG Q Y, ZHAO Q. Effect of different photoperiod on the growth and starch accumulation of duckweed. Northern Horticulture, 2017(22): 50-54.
[23] 杨舒贻, 陈晓阳, 惠文凯, 任颖, 马玲. 逆境胁迫下植物抗氧化酶系统响应研究进展. 福建农林大学学报(自然科学版), 2016, 45(5): 481-489. doi: 10.13323/j.cnki.j.fafu(nat.sci.).2016.05.001 YANG S Y, CHEN X Y, HUI W K, REN Y, MA L. Progress in responses of antioxidant enzyme systems in plant to environmental stresses. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2016, 45(5): 481-489. doi: 10.13323/j.cnki.j.fafu(nat.sci.).2016.05.001
[24] 冼康华, 苏江, 黄宁珍, 何金祥, 付传明. 光调控对金线莲生长发育的影响. 广西科学院学报, 2019, 35(1): 36-44. doi: 10.13657/j.cnki.gxkxyxb.20190123.003 XIAN K H, SU J, HUANG N Z, HE J X, FU C M. Effect of light environmental control on the growth and development of Anoectochilus roxburghii. Journal of Guangxi Academy of Sciences, 2019, 35(1): 36-44. doi: 10.13657/j.cnki.gxkxyxb.20190123.003
[25] 赵宝平, 张娜, 任长忠, 刘景辉, 莫非. 光周期对燕麦生育时期和穗分化的影响. 生态学报, 2011, 31(9): 2492-2500. ZHAO B P, ZHANG N, REN C Z, LIU J H, MO F. Ecophysiological mechanism of photoperiod affecting phenological period and spike differentiation in oat (Avena nuda L.). Acta Ecologica Sinica, 2011, 31(9): 2492-2500.
[26] GHOTBI-RAVANDI A A, SHAHBAZI M, SHARIATI M, MULO P. Effects of mild and severe drought stress on photosynthetic efficiency in tolerant and susceptible barley (Hordeum vulgare L.) genotypes. Journal of Agronomy and Crop Science, 2014, 200(6): 403-415. doi: 10.1111/jac.12062
[27] 罗远华, 王振波, 黄敏玲, 钟淮钦. 文心兰不同生育期茎叶生理指标的动态变化. 福建农业学报, 2017, 32(7): 719-723. doi: 10.19303/j.issn.1008-0384.2017.07.006 LUO Y H, WANG Z B, HUANG M L, ZHONG H Q. Physiological indices on top-leaves and pseudo-bulbs of Oncidium at different growth stages. Fujian Journal of Agricultural Sciences, 2017, 32(7): 719-723. doi: 10.19303/j.issn.1008-0384.2017.07.006
[28] 王峰, 闫家榕, 陈雪玉, 姜程浩, 孟思达, 刘玉凤, 许涛, 齐明芳, 李天来. 光调控植物叶绿素生物合成的研究进展. 园艺学报, 2019, 46(5): 975-994. doi: 10.16420/j.issn.0513-353x.2018-0799 WANG F, YAN J R, CHEN X Y, JIANG C H, MENG S D, LIU Y F, XU T, QI M F, LI T L. Light regulation of chlorophyll biosynthesis in plants. Acta Horticulturae Sinica, 2019, 46(5): 975-994. doi: 10.16420/j.issn.0513-353x.2018-0799
[29] 何俊俊, 杨京平, 杨虎, 赵杏, 叶欣怡. 光照及氮素水平对水稻冠层叶片SPAD值动态变化的影响. 浙江大学学报(农业与生命科学版), 2014, 40(5): 495-504. HE J J, YANG J P, YANG H, ZHAO X, YE X Y. Effects of light intensity and nitrogen supply on the dynamic characteristics of leaf SPAD value of rice canopy. Journal of Zhejiang University (Agriculture and Life Sciences), 2014, 40(5): 495-504.
[30] 韦朝妹, 胡小京, 李晓慧, 冉旭. 不同LED补光时长对多肉‘艳日辉’形态及生理的影响. 分子植物育种, 2023, 21(7): 2356-2364. WEI C M, HU X J, LI X H, RAN X. Effect of different LED supplemental time on the morphology and physiology of Aeonium decorum f. variegata. Molecular Plant Breeding, 2023, 21(7): 2356-2364.
[31] 张瑞洁, 贺忠群, 李春燕, 莫建超, 谢永东. 植物工厂中光周期对番杏光合特性及品质的影响. 应用与环境生物学报, 2022, 28(4): 989-994. doi: 10.19675/j.cnki.1006-687x.2021.11017 ZHANG R J, HE Z Q, LI C Y, MO J C, XIE Y D. Effects of photoperiod on photosynthetic characteristics and quality of Tetyagonia tetragonoides (Pall.) Kuntze in a plant factory. Chinese Journal of Applied and Environmental Biology, 2022, 28(4): 989-994. doi: 10.19675/j.cnki.1006-687x.2021.11017
[32] 严加坤, 张宁宁, 张岁岐. 谷子对干旱胁迫的生理生态响应. 生态学报, 2021, 41(21): 8612-8622. YAN J K, ZHANG N N, ZHANG S Q. Physiological and ecological responses of foxtail millet to drought stress. Acta Ecologica Sinica, 2021, 41(21): 8612-8622.
[33] 李孟洋, 韩怡, 王玉卓. 缩短光周期对茅苍术生理生化指标的影响. 北方园艺, 2021(14): 122-127. LI M Y, HAN Y, WANG Y Z. Effects of shortening the photoperiod on physiological biochemistry index of Atractylodes lancea. Northern Horticulture, 2021(14): 122-127.
-
期刊类型引用(2)
1. 项晶,杨飞,蒋丽琳,范良英,范玉洁,毕亚玲. 碎米知风草对不同环境因子的适应性及化学防治药剂的筛选. 草业科学. 2024(06): 1371-1383 .  本站查看
本站查看
2. 李华欣,王龙,马茜茹,裴大妹,肖麓. 白菜型油菜CCT基因的全基因组鉴定及表达模式分析. 草业科学. 2024(11): 2637-2650 .  本站查看
本站查看
其他类型引用(0)



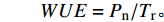

 下载:
下载: