盐胁迫下菊芋生长和生理指标对生物炭的响应
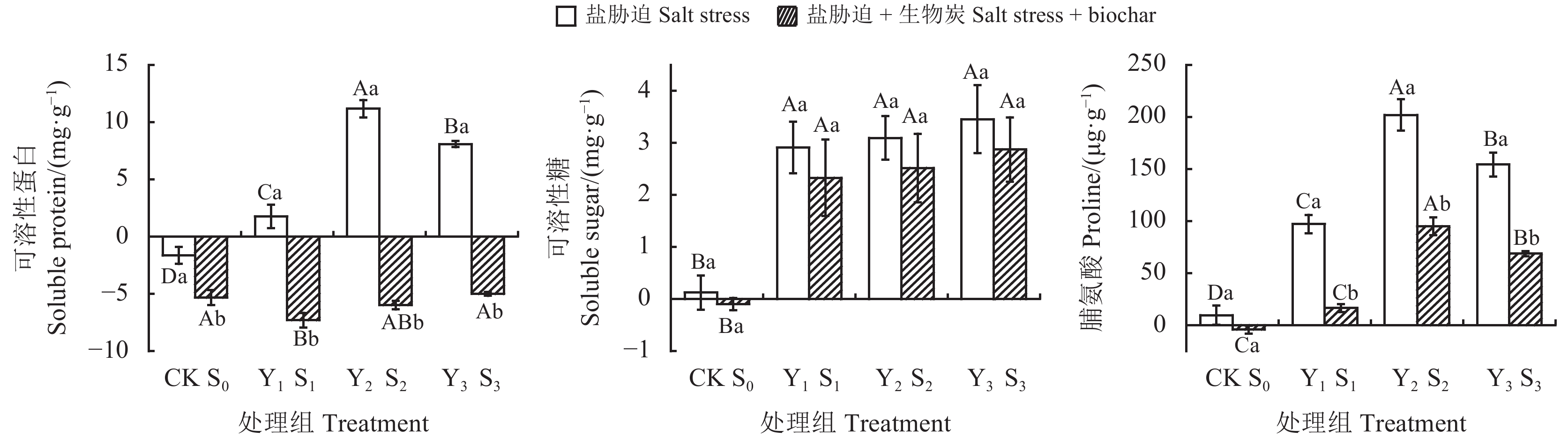
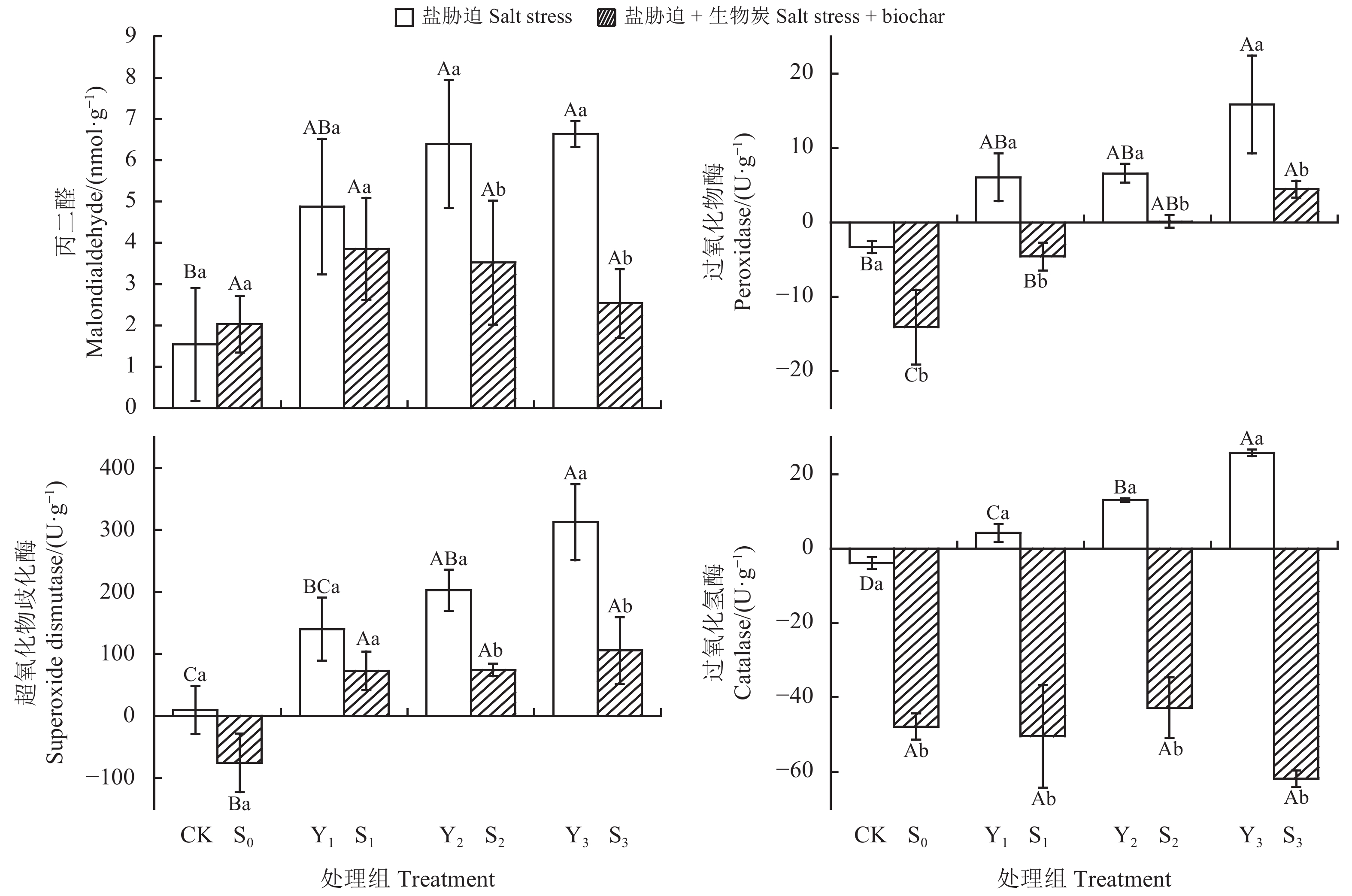
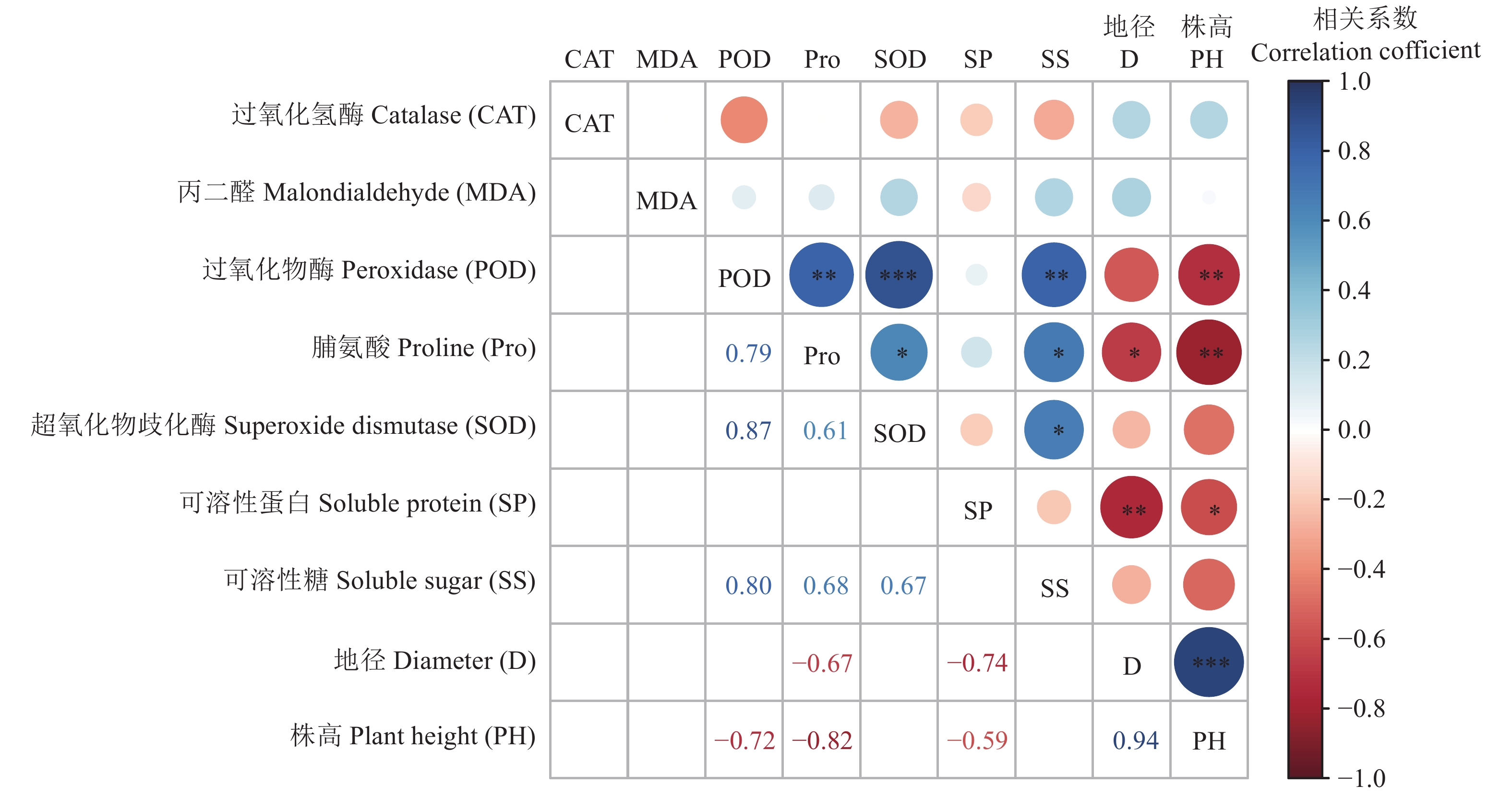
为探究菊芋(Helianthus tuberosus)对不同浓度盐胁迫初期的响应机制,揭示生物炭对不同浓度盐胁迫初期菊芋渗透调节作用和抗氧化系统的短期影响,本研究采用盆栽试验,以菊芋块根为材料,设置8种处理:无盐胁迫空白对照(CK)、1.67 g·kg−1盐胁迫(Y1)、3.35 g·kg−1盐胁迫(Y2)、5.02 g·kg−1盐胁迫(Y3)、无盐胁迫 + 5%生物炭(S0)、1.67 g·kg−1盐胁迫 + 5%生物炭(S1)、3.35 g·kg−1盐胁迫 + 5%生物炭(S2)、5.02 g·kg−1盐胁迫 + 5%生物炭(S3),分析不同浓度盐胁迫初期生物炭添加量对菊芋株高、地径、渗透调节物质含量、丙二醛(MDA)含量及抗氧化酶活性的影响。结果表明:1)菊芋能在0~1.67 g·kg−1土壤含盐量范围内正常生长,当土壤含盐量超过3.35 g·kg−1时会形成盐胁迫,显著抑制菊芋生长(P < 0.05),可溶性蛋白(SP)、可溶性糖(SS)、脯氨酸(Pro)等渗透调节物质含量和MDA含量均显著增加(P < 0.05),过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等酶活性显著提高(P < 0.05)。2)生物炭可有效提高菊芋对盐胁迫的抵抗能力,显著降低MDA含量,缓解盐胁迫对菊芋生长抑制作用,其中,相比5.02 g·kg−1盐胁迫,生物炭处理的SP、SS、Pro增量分别下降了161.76%、16.83%、55.48%,MDA增量下降了61.83%,POD、SOD、CAT活性也分别降低了71.85%、66.25%、340.05%。因此,添加生物炭能有效缓解由盐胁迫导致的膜脂过氧化作用,提高抗氧化能力,增强菊芋对盐胁迫的抵抗能力。
English
-
饲料原料的缺乏以及饲喂成本高是限制养殖业快速发展的重要因素。因此,需要大力开发和利用农工副产品等非常规饲料来配置家畜饲粮,以达到最佳的利用效率和生产的经济效益[1]。我国是最大的苹果(Malus pumila)生产国家,甘肃特殊的西北黄土高原气候、土壤、环境等高度符合优质苹果生产所需条件,是我国生产苹果的重要优势产区[2]。种植以及生产成特定产品过程中产生的大量苹果渣,可以用作动物饲料,不仅可以有效降低饲养成本,而且可高效利用农业副产品,减少生产资源浪费,提高农业副产品非常规饲料的利用,是亟需解决的问题。但由于苹果渣含水量高,不宜过久存放,变质后易产生难闻的气味,阻碍家畜利用。将苹果渣调制成发酵型全混合日粮,成功解决了饲料原料难以存放这一问题,提高了生产过程中废弃物苹果渣作为非常规饲料原料的适用性。目前,制备发酵全混合日粮已经成为许多地区用来保存反刍动物饲料高水分的有效方法之一。相比于普通全混合日粮(TMR),发酵型全混合日粮(FTMR) pH低,氨氮、乙酸、乳酸含量高[3];还可以有效减少青贮过程中饲料营养物质的损失,提高代谢能水平[4]。Silva等[5]发现,饲喂FTMR,可提高营养物质消化率和瘤胃丙酸、总挥发性脂肪酸和氨氮的浓度。不仅如此,FTMR具有更高的可消化能量和粗蛋白质含量,从而使尿氮排泄增加,粪氮排泄减少[6]。
发酵饲料作为一种保存饲料的传统方法,不仅可以保证青绿饲料的品质,在发酵过程中还可以产生有益菌,利于反刍动物消化吸收。作为一种重要的饲料资源,在反刍动物日粮的组成中占50%~100% [7]。用石榴(Punica granatum)渣和葡萄(Vitis vinifera)渣等富含多酚类物质副产品处理的发酵饲料饲喂奶牛,可以提高奶牛的抗氧化能力[8]。用苹果渣饲喂育肥牛,增重效果与苹果渣的添加量正相关[9]。Khosravi等[10]发现,用具有抗氧化酚的高粱(Sorghum bicolor)青贮饲喂奶牛,可以显著提高牛奶中多不饱和脂肪酸的浓度。Tian等[11]也表明,富含花青素的青贮玉米(Zea mays)秸秆饲喂奶山羊,可以显著提高奶中花青素的含量。因此发酵饲料的品质和营养成分对反刍动物生产健康有非常大的影响。发酵饲料最常用的添加菌剂是乳酸菌,但对木质纤维素的降解还存在一定的不足[12],可能是对发酵饲料中纤维素消化率没有显著影响的原因。因此,各种纤维素酶产品的开发接踵而来,但纤维素酶在青贮过程中,更倾向于利用容易消化的营养成分,并没有显著提高牧草很大一部分中性洗涤纤维消化率,效果并不十分显著[13]。因为植物细胞壁中的阿魏酸与木质素通过酯键连接,木质素与半纤维素之间的阿魏酸交联,限制了外源酶对多糖的降解,降低了植物细胞壁在瘤胃中发酵的关键成分[14],从而造成干物质和中性洗涤纤维消化率下降[13]。兰州大学反刍动物营养与饲料团队前期试验分离出的产阿魏酸酯酶可以使饲料中植物细胞壁结构松散,有效减少植物细胞壁中的阿魏酸含量;并通过验证发现,玉米秸秆和巨菌草(Cenchrus fungigraminus)青贮饲料添加产阿魏酸酯酶乳酸菌,有较好的木质纤维素降解性能,以及增加了饲料中游离阿魏酸的含量[15-16]。但也有研究报道,产阿魏酸酯酶乳酸菌并不能有效降解纤维素[13, 17-18],这些研究结果并不一致。因此,本试验选择产阿魏酸酯酶的植物乳杆菌A1发酵TMR,以期达到饲料中纤维素可以充分降解的效果,从而提高饲料的消化率。但很少有研究证实,添加产阿魏酸酯酶乳酸菌FTMR饲喂反刍动物后,对瘤胃消化产生的影响,饲喂效果更是不得而知。基于此,探究用产阿魏酸酯酶的植物乳杆菌A1发酵苹果渣等非常规饲料配置的TMR对肉牛整体生产性能、瘤胃发酵参数和胃肠道微生物多样性的影响,以期为添加苹果渣的FTMR的制备和对反刍动物饲喂效果提供有效数据及科学依据。
1. 材料与方法
1.1 试验材料
本试验接种的发酵菌株为植物乳杆菌A1 (Lactobacillus plantarum A1),由甘肃普诺贝康生物科技有限责任公司研发的‘青芯牧歌’。制备发酵饲料的详细操作方法参考文献[19]。
1.2 试验设计
1.2.1 试验动物
饲养试验于2023年7月-9月在甘肃省定西市生态养殖牛场进行。采用单因素完全随机试验设计。选取50头体质健康、体重相近[(630.0 ± 5.5) kg]的西门塔尔肉公牛,随机分为两个处理组,每组25头,每组分别单独圈舍。
1.2.2 饲粮和动物管理
对照组(CON)饲喂牛场TMR,包含65%精料(天康牛羊饲料有限公司,定西)和35%玉米青贮;试验组(FTMR)用FTMR替代50%的对照组TMR,FTMR包含47.36%精料(甘肃润牧生物工程有限责任公司,金昌)、17.48%玉米(Zea mays)青贮、19.37%苹果渣、15.79%鲜苜蓿(Medicago sativa);营养水平为干物质45.80%,粗蛋白16.70%,中性与酸性洗涤纤维分别为26.70%和18.50%,能量为17.49 MJ·kg−1。试验正试期60 d,其中包括预饲期15 d。
日粮配方按照肉牛营养标准(NRC,2012)进行配置,满足日增重1.5 kg育肥肉牛营养需求,且常规营养组分与对照组TMR接近。饲粮组成和营养水平如表1所列。试验开始前对牛舍进行圈舍清洁、消毒以及驱虫等准备工作,并由专人管理,定期清洁饮水槽和打扫畜舍。整个试验期间,分别在每天07:30和17:30各饲喂一次,全天自由饮水。
表 1 日粮组成和营养水平Table 1. Dietary composition and nutrient level项目
Item对照组
CON试验组
FTMR日粮组成 Diet composition 精料1 Concentrate 1/% 65.00 32.50 精料2 Concentrate 2/% 0.00 23.68 玉米青贮 Corn silage/% 35.00 26.24 苹果渣 Apple pomace/% − 9.69 鲜苜蓿 Fresh alfalfa/% − 7.89 合计 Total/% 100.00 100.00 营养水平 Nutritional level 干物质 Dry matter/% 48.50 47.15 粗蛋白 Crude protein/% 15.80 16.25 中性洗涤纤维 Neutral detergent fiber/% 29.30 28.00 酸性洗涤纤维 Acid detergent fiber/% 22.40 20.45 能量 Energy/(MJ·kg−1) 17.81 17.65 干物质基础。CON,全混合日粮组;FTMR,发酵型全混合日粮组;营养水平均为实测值。精料1购自天康牛羊饲料有限公司,含有粗蛋白20%,中性洗涤纤维22%,酸性洗涤纤维8%;精料2购甘肃润牧生物工程有限责任公司,含有粗蛋白18%,中性洗涤纤维20%,酸性洗涤纤维9%。下同。
Dry matter basis. CON, total mixed diet group; FTMR, fermentation-type total mixed diet group; All nutritional levels were measured. Concentrate 1 purchased from Tiankang Cattle and Sheep Feed Co. LTD., containing crude protein 20%, neutral detergent fiber 22%, Acid detergent fiber 8%; Concentrate 2 purchased from Gansu Runmu Biological Engineering Co. LTD., containing crude protein 18%, neutral detergent fiber 20%, Acid detergent fiber 9%. Same below.1.3 样品采集和指标测定
1.3.1 饲草营养成分及发酵品质测定
发酵完成后,采集牛场全混合日粮和发酵的全混合饲料样品,一半放入65 ℃恒温烘箱烘至48 h,再回潮24 h,粉碎并过0.63 mm网筛,然后用自封袋保存。根据动物营养与饲料的测定方法[20],测定饲草中常规营养成分,即:干物质(dry matter,DM)、粗蛋白质(crude protein,CP)、中性洗涤纤维(neutral detergent fiber,NDF)、酸性洗涤纤维(acid detergent fiber,ADF)和酸不溶灰分(acid insoluble ash,AIA)。另一半饲草于−20 ℃冰箱保存,用于提取微生物。先用生理盐水配置10%吐温80溶液200 mL,称取CON组和FTMR组两种全混合饲料鲜样各5 g于样品瓶中,用100 mL上述吐温80溶液于4 ℃
3000 r·min−1震荡冲洗24 h后,收集冲洗液10 mL用于测定饲草中的菌群[21]。1.3.2 生长性能及经济效益分析
预饲试验期结束后,从正式试验期第1天开始,对试验动物进行空腹称重,记录初始体重数据,试验结束最后1 d记录终末体重数据,计算平均日增重。干物质采食量根据Filho等[22]方法计算。在增重、饲料成本和试验期间(2023年9月)活牛市场价基础上计算饲料增重成本、增重收益和毛利润。
1.3.3 粪便营养成分测定及营养物质表观消化率
试验结束前5 d,每组随机6头牛,每天早、晚两次采集饲料和粪便。并混匀两次采集的粪便,取10%加入硫酸固氮,用于后续测定CP含量,剩余的粪便样品存放于冰箱−20 ℃,用于其他表观营养成分的测定。饲料和粪便样品解冻,放入65 ℃恒温烘箱内烘至48 h,然后回潮24 h,粉碎并过0.63 mm网筛,放入自封袋保存。同样根据动物营养与饲料[20]的测定方法,测定样品中的DM、CP、NDF、ADF和AIA含量,并采用内源指示剂法计算营养物质表观消化率。
营养物质表观消化率 = 100% − (粪便中营养物质含量 × 饲料中酸不溶灰分含量)/(饲料中营养物质含量 × 粪便中酸不溶灰分含量) × 100%。
1.3.4 瘤胃发酵参数
正式饲喂试验结束后,每组随机6头牛空腹12 h后屠宰,采集10 mL瘤胃液于−20 ℃保存。将瘤胃液解冻,取2 mL瘤胃液于4 ℃ 4 700 r·min−1离心15 min,取上清液加入25%的偏磷酸,用0.45 µm有机滤膜过滤,采用气相色谱仪(Thermo Scientific, TRACE 1300, Milan, Italy)测定瘤胃液中总挥发性脂肪酸(total volatile fatty acid,TVFA)、乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸;气相色谱仪测定参数:温度230 ℃,色谱柱DB-FFAP (长度30.0 m,内径0.32 mm,膜厚0.25 μm,最高温度250 ℃);气化室温度220 ℃;分流比23.0;进样量1 μL。取0.2 mL上清液,依次加入亚硝基铁氰化钠和次氯酸钠,摇匀,静置10 min后,用分光光度计(UV-2300,Shimadzu,Japan)在700 nm波长下读取紫外线OD值,测定氨态氮(NH3-N),方法详见文献[23]。
1.3.5 血常规
动物屠宰前采集5 mL颈静脉血液于EDTA的抗凝管中4 ℃保存,用全自动血细胞分析仪(爱德士ProCyte Dx®,美国)对全血进行血常规(总蛋白、血红蛋白、血小板、血细胞计数)测定。
1.3.6 胃肠道微生物
屠宰后采集2 mL瘤胃液和盲肠食糜存放于−80 ℃冰箱低温保存,用于后续16s测序分析。解冻瘤胃液和肠道内容物样品,根据Ma 等[21]推荐的方法从瘤胃液和盲肠食糜样本中提取微生物总DNA,并用1%的琼脂凝胶验证DNA浓度和完整性。选用引物序列F:ACTCCTACGGGAGGCAGCA和 R:GGACTACHVGGGTWTCTAAT扩增细菌16S rRNA基因V3-V4区,用1%的琼脂凝胶电泳纯化后建库,并质检。在Illumina NovaSeq测序平台(北京擎科生物科技股份有限公司)进行双末端测序。使用Trimmomatic [24] (version 0.33)对原始数据进行质量过滤,用Cutadapt [25] (version 1.9.1)进行引物序列的识别与去除,用USEARCH [26] (version 10)对双端 reads进行拼接并去除嵌合体(UCHIME [27] , version 8.1),最终获得ASVs (amplicon sequence variants),得到有效数据用于后续微生物多样性分析。
1.4 数据分析
用Excel软件将测定的试验数据进行整理,采用Shapiro-Wilk对试验数据进行正态分布检验,符合正态分布的指标(生长性能、消化率、血常规、瘤胃发酵参数)采用SPSS 22 (IBM, Chicago, United States)软件进行t检验,不符合正态分布的指标(饲草微生物组成、胃肠道微生物多样性、细菌丰度)用Wilcoxon秩和检验。P < 0.05表示差异显著,P > 0.05表示差异不显著。
2. 结果
2.1 饲料中的微生物组成
两种饲料里面微生物存在差异,特别是乳酸菌含量,FTMR组里的丰度是36%,在CON组里的丰度是59% (图1)。
2.2 肉牛生长性能及经济效益分析
FTMR组的生长性能高于CON组,末体重和平均日增重分别增加了1.75%和15.60%,且差异显著(P < 0.01) (表2)。试验组经济效益较高(表3)。
表 2 发酵饲料对肉牛生长性能的影响(n = 25)Table 2. Effects of fermented feed on growth performance of beef cattle (n = 25)项目
Item处理 Treatment P CON FTMR 初体重
Original weigh/kg635.04 ± 10.00 634.64 ± 10.82 0.893 末体重
Final weight/kg719.74 ± 10.01 732.30 ± 12.36 < 0.01 平均日增重
Average daily gain/kg1.41 ± 0.03 1.63 ± 0.09 < 0.01 平均干物质采食量
Average dry matter
intake/(kg∙d−1)11.00 12.00 表 3 经济效益分析Table 3. Economic benefit analysis项目
Item处理 Treatment CON FTMR 每头总增重
Gross weight gain per cow/kg84 98 饲料增重成本
Feed weight gain cost/(yuan·kg−1)22 18 成本合计
Total cost of sales/(yuan·t−1)1413 1230 每头增重收益
Gain on weight per cow/yuan2856 3332 每头毛利润
Gross profit per cow/yuan1008 1568 2.3 肉牛营养物质表观消化率
FTMR组中粗蛋白质表观消化率显著高于CON组(P < 0.01),干物质、中性和酸性洗涤纤维表观消化率与CON组无显著差异(P > 0.05) (表4)。
表 4 发酵饲料对肉牛营养物质表观消化率的影响(n = 6)Table 4. Effects of fermented feed on apparent digestibility of nutrients in beef cattle (n = 6)项目
Item处理 Treatment P CON FTMR 干物质
Dry matter/%79.12 ± 3.86 80.29 ± 2.51 0.484 粗蛋白
Crude protein/%64.31 ± 1.65 74.27 ± 1.75 < 0.01 中性洗涤纤维
Neutral detergent fiber/%60.78 ± 1.43 61.33 ± 1.83 0.573 酸性洗涤纤维
Acid detergent fiber/%51.96 ± 2.51 53.36 ± 2.08 0.610 2.4 肉牛血常规
FTMR组白细胞总数、血红蛋白含量和血小板分布宽度均显著低于CON组(P < 0.05);但其他血常规指标均无显著差异(P > 0.05) (表5)。
表 5 发酵饲料对肉牛血常规的影响(n = 6)Table 5. Effect of fermented feed on blood routine of beef cattle (n = 6)项目
Item处理 Treatment P CON FTMR 红细胞总数 Total erythrocyte count/[× 1012 (cell·L−1)] 7.36 ± 0.15 7.82 ± 0.18 0.071 白细胞总数 Total white blood cells/[× 109 (cell·L−1)] 7.53 ± 1.87 5.42 ± 0.77 0.039 血红蛋白 Hemoglobin/(g·L−1) 116.38 ± 2.40 117.38 ± 3.14 0.804 血红蛋白含量 Hemoglobin content/pg 15.76 ± 0.18 14.95 ± 0.14 0.003 血红蛋白浓度 Hemoglobin concentration/(g·L−1) 321.88 ± 6.69 306.38 ± 5.27 0.065 淋巴细胞 Lymphocyte/[× 109 (cell·L−1)] 1.80 ± 0.28 1.78 ± 0.15 0.938 中间细胞 Intermediate cell/[109 (cell·L−1)] 0.78 ± 0.12 0.76 ± 0.07 0.932 粒细胞 Granulocyte/[× 109 (cell·L−1)] 4.23 ± 0.44 3.36 ± 0.34 0.144 淋巴细胞比率 Lymphocyte ratio/% 26.15 ± 2.12 31.16 ± 3.30 0.222 中间细胞比率 Lntermediate cell ratio/% 11.24 ± 1.03 13.20 ± 1.24 0.243 粒细胞比率 Granulocyte ratio/% 62.61 ± 1.96 55.64 ± 3.58 0.110 红细胞压积 Packed cell volume/% 36.15 ± 0.73 38.25 ± 0.74 0.063 红细胞平均体积 Mean corpuscular volume/fL 49.26 ± 0.76 48.98 ± 0.51 0.757 红细胞分布宽度 Red blood cell distribution width SD/fL 25.55 ± 0.77 27.65 ± 1.38 0.204 红细胞分布宽度 Red blood cell distribution width/% 15.20 ± 0.26 16.53 ± 0.67 0.087 血小板总数 Total platelet count/[× 109 (cell·L−1)] 223.87 ± 31.98 205.25 ± 25.46 0.656 血小板平均体积 Mean platelet volume/fL 6.65 ± 0.16 6.556 ± 0.09 0.551 血小板分布宽度 Platelet distribution width/% 8.29 ± 0.24 7.18 ± 0.37 0.024 血小板压积 Thrombocytocrit/% 0.14 ± 0.02 0.13 ± 0.02 0.604 血小板大细胞比率 Platelet macrocell ratio/% 4.44 ± 1.31 1.43 ± 0.69 0.061 2.5 肉牛瘤胃发酵参数
FTMR组总挥发性脂肪酸浓度显著高于CON组(P = 0.026),乙酸和丙酸含量也显著高于CON组(P < 0.05);其他发酵参数含量两组间均无显著差异(P > 0.05) (表6)。
表 6 发酵饲料对肉牛瘤胃发酵参数的影响(n = 6)Table 6. Effects of fermented feed on rumen fermentation parameters of beef cattle (n = 6)项目
Item处理 Treatment P CON FTMR 总挥发性脂肪酸 Total VFA/(mmol·L−1) 131.25 ± 16.05 185.49 ± 12.88 0.026 乙酸/丙酸 Acetate/ propionate 2.96 ± 0.15 2.73 ± 0.18 0.350 乙酸 Acetate/(mmol·L−1) 77.26 ± 9.37 108.04 ± 6.76 0.023 丙酸 Propionate/(mmol·L−1) 28.60 ± 3.16 40.55 ± 3.90 0.039 丁酸 Butyrate/(mmol·L−1) 24.04 ± 3.81 28.38 ± 2.61 0.370 异丁酸 Isobutyrate/(mmol·L−1) 1.36 ± 0.47 1.83 ± 0.20 0.371 戊酸 Valerate/(mmol·L−1) 1.91 ± 0.27 2.65 ± 0.35 0.126 异戊酸 Isovalerate/(mmol·L−1) 2.93 ± 0.28 4.04 ± 0.43 0.055 氨氮 Ammonia-nitrogen/(mg·dL−1) 7.10 ± 2.97 10.32 ± 2.41 0.207 2.6 肉牛瘤胃细菌多样性
2.6.1 α多样性和β多样性
两组之间α多样性均无显著差异(P > 0.05) (图2A-D);β多样性NMDS分析结果显示(图2E),两组之间样品分布距离较远,瘤胃微生物菌群结构差异较大(Stress = 0.088 6)。
2.6.2 细菌丰度差异分析
门水平组间差异物种分析显示(表7),CON组瘤胃疣微菌门(Verrucomicrobiota)的相对丰度极显著高于FTMR组(P < 0.01),但纤维杆菌门(Fibrobacterota)的相对丰度低于FTMR组(P > 0.05);属水平组间差异物种分析显示(表8),CON组瘤胃的Prevotella、Prevotellaceae_UCG_003、unclassified_Bacteroidales_RF16_group、Veillonellaceae_UCG_001、UCG_004、Selenomonas、unclassified_Succinivibrionaceae、uncultured_rumen_bacterium_4C0d_9 Anaerovibrio和unidentified_rumen_bacterium_RFN46的相对丰度均显著高于FTMR组(P < 0.05),但Fibrobacter、Prevotellaceae_NK3B31_group、Prevotellaceae_UCG_004、Lachnoclostridium、Lachnospiraceae_UCG_008、Lachnospiraceae_FCS020_group、Lachnospiraceae_NK4A136_group、Lachnospiraceae_UCG_006和[Anaerorhabdus]_furcosa_group相对丰度均显著低于FTMR组(P < 0.05)。
表 7 两组对瘤胃微生物门水平丰度比较(n = 6)Table 7. Comparison of rumen microbial phylum level abundance between in two treatments (n = 6)门水平
Phylum level处理 Treatment P CON FTMR 疣微菌门
Verrucomicrobiota/%0.049 ± 0.027 0.010 ± 0.004 0.003 纤维杆菌门
Fibrobacterota/%0.005 ± 0.003 0.015 ± 0.007 0.336 表 8 两组对瘤胃微生物属水平丰度比较(n = 6)Table 8. Comparison of rumen microbial genus level abundance between in two treatments (n = 6)属水平
Genus level处理 Treatment P CON FTMR Prevotella 0.211 ± 0.069 0.121 ± 0.026 0.006 Prevotellaceae_UCG_003 0.016 ± 0.002 0.011 ± 0.002 0.006 unclassified_Bacteroidales_RF16_group 0.019 ± 0.010 0.005 ± 0.003 0.009 Fibrobacter 0.005 ± 0.003 0.015 ± 0.006 0.010 Veillonellaceae_UCG_001 0.011 ± 0.003 0.004 ± 0.002 0.010 UCG_004 0.011 ± 0.008 0.004 ± 0.002 0.010 Prevotellaceae_NK3B31_group 0.002 ± 0.002 0.011 ± 0.003 < 0.001 Prevotellaceae_UCG_004 0.002 ± 0.001 0.007 ± 0.002 0.001 Lachnoclostridium 0.002 ± 0.001 0.004 ± 0.002 0.010 Selenomonas 0.004 ± 0.004 0.001 ± 0.001 0.030 unclassified_Succinivibrionaceae 0.003 ± 0.002 0.001 ± 0.001 0.016 Lachnospiraceae_UCG_008 0.001 ± 0.001 0.003 ± 0.001 0.003 Lachnospiraceae_FCS020_group 0.001 ± 0.001 0.002 ± 0.002 < 0.001 Lachnospiraceae_NK4A136_group 0.001 ± 0.001 0.002 ± 0.001 0.003 Lachnospiraceae_UCG_006 0.001 ± 0.001 0.002 ± 0.001 0.025 Ruminobacter 0.002 ± 0.001 0.004 ± 0.001 0.01 uncultured_rumen_bacterium_4C0d_9 0.002 ± 0.000 0.001 ± 0.000 0.016 Anaerovibrio 0.002 ± 0.001 0.001 ± 0.001 0.025 [Anaerorhabdus]_furcosa_group 0.000 ± 0.000 0.002 ± 0.001 0.025 unidentified_rumen_bacterium_RFN46 0.001 ± 0.001 0.000 ± 0.000 0.016 2.7 肉牛盲肠细菌多样性
2.7.1 α多样性和β多样性
两组之间α多样性均无显著差异(P > 0.05) (图3A-D);β多样性NMDS分析结果显示(图3E),两组之间样品分布距离较近,盲肠微生物菌群结构差异较小(Stress = 0.099 0)。
2.7.2 细菌丰度差异分析
门水平组间差异物种分析显示(表9),两组之间细菌丰度无显著差异(P > 0.05);属水平组间差异物种分析显示(表10),FTMR组盲肠Clostridium_sensu_stricto_1、Turicibacter、Romboutsia、uncultured_rumen_bacterium、Parabacteroides和unclassified_unidentified_rumen_bacterium_RF39的细菌丰度均显著高于CON组(P < 0.05),但Lachnospiraceae_UCG_001、Dorea、Candidatus_Stoquefichus、unclassified_Alphaproteobacteria、unclassified_Paludibacteraceae和unclassified_Erysipelotrichales的细菌丰度均显著低于CON组(P < 0.05)。
表 9 两组对盲肠微生物门水平丰度比较(n = 6)Table 9. Comparison of the abundance of cecum microorganisms phylum level in two treatments (n = 6)门水平
Phylum level处理 Treatment P CON FTMR Firmicutes 0.568 ± 0.036 0.600 ± 0.045 0.841 Bacteroidota 0.273 ± 0.080 0.299 ± 0.040 0.958 Proteobacteria 0.081 ± 0.100 0.032 ± 0.039 0.841 Spirochaetota 0.052 ± 0.044 0.040 ± 0.030 0.841 Patescibacteria 0.007 ± 0.002 0.009 ± 0.003 0.841 Actinobacteriota 0.007 ± 0.007 0.010 ± 0.014 0.841 Verrucomicrobiota 0.003 ± 0.001 0.005 ± 0.007 0.841 Fusobacteriota 0.003 ± 0.002 0.002 ± 0.002 0.841 Desulfobacterota 0.002 ± 0.002 0.001 ± 0.001 0.841 Cyanobacteria 0.001 ± 0.001 0.001 ± 0.001 0.841 Acidobacteriota 0.0010 ±0.0010 0.0001 ±0.0001 0.841 unclassified_Bacteria 0.0004 ±0.0005 0.0002 ±0.0001 1.000 Cloacimonadota 0.0003 ±0.0008 0 0.841 Chloroflexi 0.0002 ±0.0005 0.0001 ±0.0001 0.999 Gemmatimonadota 0.0002 ±0.0005 0.00004 ±0.00005 0.841 Myxococcota 0.0001 ±0.0003 0.00002 ±0.00003 1.000 Campylobacterota 0.00009 ±0.00022 0.00003 ±0.00003 0.841 Elusimicrobiota 0.00007 ±0.00011 0.00004 ±0.00006 0.999 Deferribacterota 0.00008 ±0.00018 0 0.841 Methylomirabilota 0.00007 ±0.00018 0 0.841 表 10 两组对盲肠微生物属水平丰度比较(n = 6)Table 10. Comparison of the abundance of cecum microorganisms genus level in two treatments (n = 6)属水平
Genus level处理 Treatment P CON FTMR Clostridium_sensu_stricto_1 0.015 ± 0.008 0.025 ± 0.005 0.037 Turicibacter 0.006 ± 0.002 0.024 ± 0.014 0.004 Romboutsia 0.008 ± 0.001 0.021 ± 0.012 0.004 uncultured_rumen_bacterium 0.007 ± 0.003 0.016 ± 0.004 0.010 Lachnospiraceae_UCG_001 0.004 ± 0.002 0.002 ± 0.002 0.025 Parabacteroides 0.0006 ±0.0004 0.0039 ±0.0042 0.016 Dorea 0.0019 ±0.0008 0.0009 ±0.0007 0.037 Candidatus_Stoquefichus 0.0016 ±0.0009 0.0005 ±0.0008 0.037 unclassified_unidentified_rumen_bacterium_RF39 0.0004 ±0.0003 0.0016 ±0.0008 0.001 unclassified_Paludibacteraceae 0.0016 ± 0.0010.0003 ±0.0003 0.016 unclassified_Alphaproteobacteria 0.0010 ±0.0004 0.0003 ±0.0002 0.025 unclassified_Erysipelotrichales 0.0004 ±0.0002 0.0001 ±0.0002 0.025 3. 讨论与结论
3.1 发酵TMR对肉牛生长和消化的影响
苹果渣一般是指苹果用来生产果酱、果酒以及苹果汁后产生的副产品残渣,含有丰富的营养组成,氨基酸、多糖、膳食纤维、矿物质等,饲喂价值高[28]。但苹果渣含水量高、易变质,且其收获季节集中在10月[29],严重限制了苹果渣在反刍动物生产中的应用。本研究选择与发酵全混合日粮养分组成接近的典型育肥饲粮作为对照,从动物生长、养分消化和瘤胃发酵多个方面充分验证发酵技术实现苹果渣高效利用的可行性和有效性。两组饲草微生物组成不同,FTMR组饲草中乳酸菌含量显著低于对照组。牧草表面附着的微生物组成和数量受不同植物和发酵环境影响[30],玉米青贮在发酵过程中乳酸菌数量显著高于苜蓿草[31],因此,对照组中产生大量乳酸菌是饲料中玉米青贮发酵的结果。FTMR组中Gemmatimonadaceae和Muribaculaceae细菌丰度更高,由于发酵底物的不同,在发酵过程中微生物演变更替,互相竞争,更能适应环境的微生物主导发酵过程[32]。
体增重是衡量家畜生产性能最重要的指标。苹果加工后的副产物苹果渣,含有多糖和膳食纤维等,利于消化吸收,可以提高饲料适口性,改善动物生长性能,饲喂和营养价值高[9]。张琨[33]发现羔羊饲料中添加10%的干苹果渣可以显著提高羔羊的末重和日增重。马宁等[9]在育肥牛饲料中添加烘干苹果渣,可以显著增加育肥牛的体重,并改善生长性能。本研究利用发酵技术将鲜苹果渣添加到饲料中制备成发酵型全混合日粮,试验表明苹果渣发酵饲料显著提高了肉牛的末体重和平均日增重,证实发酵全混合日粮技术可以实现肉牛生产中苹果渣长期保存和高效利用。
饲料发酵过程中,原料大分子如蛋白质在多种消化酶的作用下进一步分解为小分子物质[34]。大量动物试验证实,饲喂前饲料发酵有利于提高牛羊饲料消化率[35-39]。本研究中FTMR组苜蓿草含量更高,更有利于动物对蛋白质消化[40]。通常情况下,利用乳酸菌发酵饲粮不会降解粗纤维素。研究证实发酵饲料对中性洗涤纤维和酸性洗涤纤维表观消化率无显著影响[39],发酵低质粗饲料后甚至会降低动物对粗纤维素的消化率[41]。本研究使用的是一类可以降解纤维素的的乳酸菌(产阿魏酸酯酶的植物乳杆菌A1),体外结果证实其具有改变青贮发酵过程中植物细胞壁结构,降低青贮木质纤维素的结晶度,从而降解木质纤维素的作用[19]。本研究中饲喂FTMR对肉牛NDF和ADF消化率没有影响。饲料原料不同,FTMR组中粗料NDF含量低,易发酵底物如苹果渣和苜蓿含量多。精料中NDF的物理有效中性洗涤纤维(peNDF)含量低,饲料发酵过程中降解率也高[42],最终减少动物对饲料咀嚼时间及唾液分泌量,导致粗饲料的可溶解部分和潜在可以消化部分降低[43],达不到显著降解饲料中纤维消化率的效果。要验证产阿魏酸酯酶的植物乳杆菌A1菌是不是在体内也能促进纤维降解,控制有效纤维水平可能更重要,具体效果有待进一步研究。
3.2 发酵TMR对肉牛血液生化的影响
动物机体健康、新陈代谢以及内环境平衡等状态,可以通过血常规指标变化间接反映。血液中白细胞总数反映动物机体的炎症情况[44]。研究表明,当饲料中添加5%和10%复合益生菌发酵饲料可以显著降低哺乳羔羊白细胞总数,降低炎症反应[45]。本研究结果显示,FTMR组白细胞总数显著低于对照组,与上述研究结果相一致,表明饲料中添加适宜的发酵饲料可以减轻炎症反应利于机体健康。血液中3个指标(血红蛋白含量、血红蛋白浓度和红细胞平均体积)反映了红细胞中血红蛋白的含量、体积以及颜色,当含量较低时,可能机体铁含量或者吸收出现障碍,也是鉴定贫血和异常造血的重要指标[46]。本研究中,FTMR组肉牛血红蛋白含量显著低于对照组,单独以血红蛋白含量这一个指标来判断红细胞变化的意义不大,说明发酵饲料不影响机体造血功能,也不抑制机体促红细胞生成素的释放,不会造成机体贫血[47]。血液中血小板分布宽度和平均血小板体积的升高与机体内血小板凝血活性成正比,主要与心血管疾病有关,对维持机体的正常血液循环有显著意义[37, 48]。本研究FTMR组血小板分布宽度显著低于对照组,说明饲喂发酵饲料有助于降低心血管疾病的风险,再次证明发酵饲料对于机体的健康生长有积极效果,与促进生长性能试验结果相一致。
3.3 发酵TMR对肉牛瘤胃发酵参数和微生物多样性的影响
反刍动物瘤胃内挥发性脂肪酸是反刍动物主要的能量来源,可以反映饲料在瘤胃内的发酵分解情况。乙酸和丙酸是主要的发酵参数[49]。调控瘤胃发酵的方式有很多种,其中调整饲粮组成较为常见。发酵饲料可以显著提高绵羊瘤胃挥发性脂肪酸的含量[50]。孔雪旺等[51]研究也表明,使用全混合日粮 + 发酵饲料进行离体试验,提高了肉牛挥发性脂肪酸的产量。张政[52]和郭鹏[53]体外发酵试验都发现,饲料被微生物发酵后,显著提高了奶牛瘤胃中总挥发性脂肪酸、乙酸、丙酸的含量。而陈光吉等[54]也有相似的结果,但对乙酸/丙酸的比例无显著影响。杨红建等[55]把农作物秸秆用阿魏酸酯酶发酵72 h 后发现,促进了微生物对饲料中细胞壁的降解,增加了瘤胃挥发性脂肪酸的浓度。本研究中,FTMR组瘤胃中总挥发性脂肪酸、乙酸和丙酸的含量均显高于对照组,与上述研究结果类似。可能是在饲料添加产阿魏酸酯酶的植物乳杆菌A1后,在发酵过程中,家畜瘤胃微生物加快了对饲料的降解,更充分的发酵利用营养物质,从而为机体提供更多能量。
瘤胃健康与瘤胃微生物丰度密切相关,16SrRNA高通量测序技术很好地测定出反刍动物瘤胃微生物多样性。本研究中,β多样性NMDS分析显示,FTMR组与对照组细菌菌群结构有一定不同,但没有显著差异。瘤胃细菌受多种因素影响,尽管两个组间肉牛饲料品质上有一定区别,但并不足以导致改变复杂的瘤胃微生物组成。众所周知,瘤胃厚壁菌门和纤维杆菌门主要用于分解饲料中纤维素利于反刍动物对纤维的消化吸收,本研究中,细菌门水平,FTMR组纤维杆菌门细菌丰度较高,属水平厚壁菌门中(Lachnoclostridium、Lachnospiraceae_UCG_008、Lachnospiraceae_FCS020_group、Lachnospiraceae_NK4A136_group、Lachnospiraceae_UCG_006)和纤维杆菌门中(Fibrobacter)细菌丰度显著高于对照组。有研究表明,LpA1产生的阿魏酸酯酶可以降解木质纤维素[16],日粮中添加纤维素酶也可以增加一些与纤维分解菌相关细菌的丰度,这也与本研究结果相一致[56]。因此,研究结果表明,FTMR组的产阿魏酸酯酶的植物乳杆菌A1发挥了作用,并可能增加了细菌在饲料中的附着能力,刺激降解饲料中纤维素类微生物的活性。但关于最终纤维消化率并没有显著增加还需进一步研究。普雷沃氏菌属主要参与淀粉与蛋白质的降解,也与纤维物质降解有关[57]。本研究属水平结果显示,对照组Prevotella和Prevotellaceae_UCG_003的相对丰度显著高于FTMR,但Prevotellaceae_NK3B31_group和Prevotellaceae_UCG_004的相对丰度显著低于FTMR组。这些细菌都属于普雷沃氏菌属,而导致这种现象产生的原因可能与这些细菌的特性有较大关系。
3.4 发酵TMR对肉牛盲肠微生物多样性的影响
肠道微生物对反刍动物的正常生长也发挥一定调控作用[58]。肠道微生物可以降解一部分反刍动物摄入的纤维物质,但它们参与更多的糖和氨基酸代谢,肠道中微生物紊乱也同样影响养分消化吸收,甚至引起机体发生疾病[59]。因此,本研究用16SrRNA高通量测序技术测定反刍动物盲肠微生物多样性。分析盲肠微生物组成发现,在属水平上,FTMR组盲肠毛螺菌属(Lachnospiraceae_UCG_001)和Dorea细菌丰度显著低于CON组。Lachnospiraceae_UCG_001和Dorea菌属均属于厚壁菌门,但两组间纤维素表观消化率并没有显著差异,从微生物的角度考虑也可能是由于FTMR组中,瘤胃中关于降解纤维素的细菌属丰度高于对照组。但FTMR组盲肠梭状芽孢杆菌(Clostridium_sensu_stricto_1)、Turicibacter、罗姆布茨菌(Romboutsia)、狄氏副拟杆菌(Parabacteroides)的细菌丰度均显著高于CON组。Romboutsia被认为是一种有益菌,与肠道疾病负相关[60],而关于Turicibacter在反刍动物中研究较少。Clostridium_sensu_stricto_1在动物蛋白质饲料和氨基酸利用中发挥重要作用,因此该细菌属的显著增加可能在蛋白质利用中发挥作用[61]。正如预期结果,本研究中FTMR组蛋白质表观消化率显著增加。Parabacteroides与机体糖代谢显著相关,并发挥正反馈作用,激活肠道糖异生,从而调节食欲,改善糖代谢紊乱,是一种潜在的新型抗代谢综合症益生菌[62]。这与本研究生产性能结果中FTMR组日增重显著高于对照组相一致。这些结果均进一步证实了FTMR饲料增加了肠道微生物有益菌属的丰度,从而更好地获取和利用饲料中能量和营养,维持机体健康。
综上,产阿魏酸酯酶乳酸菌发酵TMR与营养组分接近的典型育肥TMR饲粮相比,可以增加肉牛平均日增重和粗蛋白质表观消化率,减少白细胞总数和血小板分布宽度,降低疾病风险,改善生产性能;增加瘤胃总挥发酸、乙酸和丙酸的含量,胃肠道有益菌属(Firmicutes、Clostridium_sensu_stricto_1和Parabacteroides)的丰度,保障了胃肠道健康。因此,全混合饲粮发酵技术可以有效利用易腐败的饲料原料,促进肉牛生长速率、维护胃肠道健康。
参考文献
[1] 杨劲松, 姚荣江, 王相平, 谢文萍, 张新, 朱伟, 张璐, 孙瑞娟. 中国盐渍土研究: 历程、现状与展望. 土壤学报, 2022, 59(1): 10-27. YANG J S, YAO R J, WANG X P, XIE W P, ZHANG X, ZHU W, ZHANG L, SUN R J. Research on salt-affected soils in China: History, status quo and prospect. Acta Pedologica Sinica, 2022, 59(1): 10-27.
[2] 唐雪, 尚辉, 刘广明, 姚宇阗, 张凤华, 杨劲松, 周龙祥, 储睿. 复合改良剂对盐碱土改良及植物生长的影响. 土壤, 2021, 53(5): 1033-1039. TANG X, SHANG H, LIU G M, YAO Y T, ZHANG F H, YANG J S, ZHOU L X, CHU R. Effects of combined amendment on improvement of salinized soil and plant growth. Soils, 2021, 53(5): 1033-1039.
[3] 孔涛, 吴祥云, 刘玲玲, 闫晗. 风沙地菊芋的主要生态学特性. 生态学杂志, 2009, 28(9): 1763-1766. KONG T, WU X Y, LIU L L, YAN H. Main ecological characteristics of jerusalem artichoke ( Helianthus tuberosus) in aeolian sandy land. Chinese Journal of Ecology, 2009, 28(9): 1763-1766.
[4] 吕晓, 徐慧, 李丽, 赵雲泰. 盐碱地农业可持续利用及其评价. 土壤, 2012, 44(2): 203-207. LYU X, XU H, LI L, ZHAO Y T. Agricultural sustainable utilization and evaluation of saline-alkali land. Soils, 2012, 44(2): 203-207.
[5] AHMAD M, RAJAPAKSHA A U, LIM J E, ZHANG M, BOLAN N, MOHAN D, VITHANAGE M, LEE S S, OK S Y. Biochar as a sorbent for contaminant management in soil and water: A review. Chemosphere, 2014, 99: 19-33. doi: 10.1016/j.chemosphere.2013.10.071
[6] 贾林, 张金龙, 刘璐瑶, 王鹏山, 李志明, 田晓明. 生物炭在盐碱区域土壤环境生态修复中的应用. 环境科学与技术, 2021, 44(S2): 124-131. JIA L, ZHANG J L, LIU L Y, WANG P S, LI Z M, TIAN X M. Biochar in the saline-alkali soil environment application in ecological restoration. Environmental Science & Technology, 2021, 44(S2): 124-131.
[7] 刘旭, 白一茹, 马娴, 王幼奇. 生物炭对黄绵土水分吸渗特征及水力学参数的影响. 干旱区资源与环境, 2023, 37(3): 77-84. LIU X, BAI Y R, MA X, WANG Y Q. Effects of biochar on water absorption characteristics and hydraulic parameters of loessial soil. Journal of Arid Land Resources and Environment, 2023, 37(3): 77-84.
[8] 熊钰婷, 袁旭音, 周慧华, 高一丹, 汪宜敏. 生物炭添加对太湖滨岸带土壤氮矿化和淋失特征的影响. 环境科学, 2022, 43(2): 762-769. XIONG Y T, YUAN X Y, ZHOU H H, GAO Y D, WANG Y M. Effects of biochar addition on soil nitrogen mineralization and leaching characteristics in riparian zone of Taihu Lake. Environmental Science, 2022, 43(2): 762-769.
[9] SUN H, LU H, CHU L, SHAO H, SHI W. Biochar applied with appropriate rates can reduce N leaching, keep N retention and not increase NH3 volatilization in a coastal saline soil. Science of The Total Environment, 2017, 575: 820-825. doi: 10.1016/j.scitotenv.2016.09.137
[10] WANG S B, GAO P L, ZHANG Q W, SHI Y L, GUO X L, LV Q X, WU W, ZHANG X, LI M Z, MENG Q M. Biochar improves soil quality and wheat yield in saline-alkali soils beyond organic fertilizer in a 3-year field trial. Environmental Science and Pollution Research, 2023, 30(7): 19097-19110.
[11] YUAN P, WANG J Q, PAN Y J, SHEN B X, WU C F. Review of biochar for the management of contaminated soil: Preparation, application and prospect. Science of The Total Environment, 2019, 659: 473-490. doi: 10.1016/j.scitotenv.2018.12.400
[12] 李思源, 饶良懿. 水淹胁迫对饲料桑苗( Morus alba)生长及渗透调节物质的影响. 生态学杂志, 2022, 41(10): 1873-1880. LI S Y, RAO L Y. Effects of waterlogging stress on the growth and osmotic adjustment substances in the seeding of forage mulberry. Chinese Journal of Ecology, 2022, 41(10): 1873-1880.
[13] 薛延丰, 刘兆普. 利用叶绿素荧光参数筛选抗盐菊芋品种的初步研究. 高技术通讯, 2008, 18(7): 766-770. doi: 10.3772/j.issn.1002-0470.2008.07.020 XUE Y F, LIU Z P. A preliminary study of screening salt-resistive varieties of Helianthus tuberosus L. using chlorophyll fluorescence parameters. Chinese High Technology Letters, 2008, 18(7): 766-770. doi: 10.3772/j.issn.1002-0470.2008.07.020
[14] 吴成龙, 周春霖, 尹金来, 刘兆普, 徐阳春, 沈其荣. NaCl胁迫对菊芋幼苗生长及其离子吸收运输的影响. 西北植物学报, 2006(11): 2289-2296. doi: 10.3321/j.issn:1000-4025.2006.11.016 WU C L, ZHOU C L, YIN J L, LIU Z P, XU Y C, SHEN Q R. NaCl stress on the growth, ion uptake and transport of Helianthus tuberosus seedlings. Acta Botanica Boreali-Occidentalia Sinica, 2006(11): 2289-2296. doi: 10.3321/j.issn:1000-4025.2006.11.016
[15] 王磊, 隆小华, 孟宪法, 刘兆普, 罗以筛. 不同形态氮素配比对盐胁迫下菊芋幼苗生理的影响. 生态学杂志, 2011, 30(2): 255-261. WANG L, LONG X H, MENG X F, LIU Z P, LUO Y S. Effects of different ratios of mineral nitrogen form on Helianthus tuberosus seedlings physiology under salt stress. Chinese Journal of Ecology, 2011, 30(2): 255-261.
[16] 任智新, 史建楠, 何佳星, 王晔, 范希峰, 李润枝, 于春欣, 彭真, 高月荣, 段留生. 盐胁迫对青绿苔草生长及生理特性的影响. 草地学报, 2022, 30(8): 2045-2052. REN Z X, SHI J N, HE J X, WANG Y, FAN X F, LI R Z, YU C X, PENG Z, GAO Y R, DUAN L S. Effects of salt stress on growth and physiological characteristics of carex leucochlora. Acta Agrestia Sinica, 2022, 30(8): 2045-2052.
[17] JAISWAL A K, ELAD Y, PAUDEL I, GRABER E R, CYTRYN E, FRENKEL O. Linking the belowground microbial composition, diversity and activity to soilborne disease suppression and growth promotion of tomato amended with biochar. Scientific Reports, 2017, 7(1): 44382. doi: 10.1038/srep44382
[18] HE L L, ZHAO J, YANG S M, ZHOU H, WANG S Q, ZHAO X, XING G X. Successive biochar amendment improves soil productivity and aggregate microstructure of a red soil in a five-year wheat-millet rotation pot trial. Geoderma, 2020, 376: 114570. doi: 10.1016/j.geoderma.2020.114570
[19] 齐琪, 马书荣, 徐维东. 盐胁迫对植物生长的影响及耐盐生理机制研究进展. 分子植物育种, 2020, 18(8): 2741-2746. QI Q, MA S R, XU W D. Advances in the effects of salt stress on plant growth and physiological mechanisms of salt tolerance. Molecular Plant Breeding, 2020, 18(8): 2741-2746.
[20] 徐福乐, 罗立津, 高灿红. 植物生长调节剂对甜椒的抗寒性诱导效应研究. 农药学学报, 2011, 13(1): 33-39. doi: 10.3969/j.issn.1008-7303.2011.01.06 XU F L, LUO L J, GAO C H. Inducing effects of plant growth regulators on the chilling resistance of sweet pepper ( Capsicum annuum). Chinese Journal of Pesticide Science, 2011, 13(1): 33-39. doi: 10.3969/j.issn.1008-7303.2011.01.06
[21] 姚佳, 刘信宝, 崔鑫, 李志华. 不同NaCl胁迫对苗期扁蓿豆渗透调节物质及光合生理的影响. 草业学报, 2015, 24(5): 91-99. YAO J, LIU X B, CUI X, LI Z H. Effects of NaCl stress on substances linked to osmotic adjustment and on photosynthetic physiology of Melilotoides ruthenicain the seedling stage. Acta Prataculturae Sinica, 2015, 24(5): 91-99.
[22] 丁理成, 王尧, 李景刚, 王庆华, 王延玲. 盐肤木与泰山盐肤木幼苗对盐胁迫的生理响应. 植物生理学报, 2022, 58(7): 1335-1345. DING L C, WANG Y, LI J G, WANG Q H, WANG Y L. Physiological response of Rhus chinensis and R. taisanensis seedlings to salt stress. Plant Physiology Journal, 2022, 58(7): 1335-1345.
[23] 王磊, 隆小华, 郝连香, 刘兆普. 氮素形态对盐胁迫下菊芋幼苗PSⅡ光化学效率及抗氧化特性的影响. 草业学报, 2012, 21(1): 133-140. WANG L, LONG X H, HAO L X, LIU Z P. Effects of nitrogen form on the photochemical efficiency of PSⅡ and antioxidant characteristics of jerusalem artichoke seedling under salt stress. Acta Prataculturae Sinica, 2012, 21(1): 133-140.
[24] IQBAL N, UMAR S, KHAN N A, KHAN M I. A new perspective of phytohormones in salinity tolerance: Regulation of proline metabolism. Environmental and Experimental Botany, 2014, 100: 34-42. doi: 10.1016/j.envexpbot.2013.12.006
[25] 段海霞, 邹恭鲁, 杨永鑫, 李颖, 吕世奇, 孙杉, 赵长明. 两种基因型菊芋幼苗对盐胁迫的生长及生理响应. 干旱地区农业研究, 2018, 36(3): 176-183. DUAN H X, ZOU G L, YANG Y X, LI Y, LYU S Q, SUN S, ZHAO Z M. Growth and physiological responses of two genotypes jerusalem artichoke ( Helianthus tuberosus) seedlings under salt stress. Agricultural Research in the Arid Areas, 2018, 36(3): 176-183.
[26] 冯大伟, 张洪霞, 刘广洋, 靳志明, 刘胜一, 衣悦涛. 黄河三角洲盐胁迫对不同品种菊芋幼苗生长及生理特性的影响. 中国农学通报, 2013, 29(36): 155-159. FENG D W, ZHANG H X, LIU G Y, JIN Z M, LIU S Y, YI Y T. Effects of salt stresses on the growth and physiological characteristics of Helianthus tuberosus seedlings in yellow river delta. Chinese Agricultural Science Bulletin, 2013, 29(36): 155-159.
[27] EKINCI M, TURAN M, YILDIRIM E. Biochar mitigates salt stress by regulating nutrient uptake and antioxidant activity, alleviating the oxidative stress and abscisic acid content in cabbage seedlings. Turkish Journal of Agriculture and Forestry, 2022, 46(1): 28-37.
[28] HAFEZ Y, ATTIA K, ALAMERY S, GHAZY A, AL-DOSS A, IBRAHIM E, RASHWAN E, EI-MAGHRABY L, AWAD A, ABDELAAL K. Beneficial effects of biochar and chitosan on antioxidative capacity, osmolytes accumulation, and anatomical characters of water-stressed barley plants. Agronomy, 2020, 10(5): 630. doi: 10.3390/agronomy10050630
[29] MUNNS R, TESTER M. Mechanisms of Salinity Tolerance. Annual Review of Plant Biology, 2008, 59(1): 651-681. doi: 10.1146/annurev.arplant.59.032607.092911
[30] AKHTAR S S, ANDERSEN M N, LIU F. Biochar Mitigates Salinity Stress in Potato. Journal of Agronomy and Crop Science, 2015, 201(5): 368-378. doi: 10.1111/jac.12132
[31] AKHTAR S S, ANDERSEN M N, LIU F. Residual effects of biochar on improving growth, physiology and yield of wheat under salt stress. Agricultural Water Management, 2015, 158: 61-68. doi: 10.1016/j.agwat.2015.04.010
[32] 张金林, 李惠茹, 郭姝媛, 王锁民, 施华中, 韩庆庆, 包爱科, 马清. 高等植物适应盐逆境研究进展. 草业学报, 2015, 24(12): 220-236. ZHANG J L, LI H R, GUO S Y, WANG S M, SHI H Z, HAN Q Q, BAO A K, MA Q. Research advances in higher plant adaptation to salt stress. Acta Prataculturae Sinica, 2015, 24(12): 220-236.
[33] 毛恋, 芦建国, 江海燕. 植物响应盐碱胁迫的机制. 分子植物育种, 2020, 18(10): 3441-3448. MAO L, LU J G, JIANG H Y. Mechanisms of plant responses to salt-alkali stress. Molecular Plant Breeding, 2020, 18(10): 3441-3448.
[34] 王佺珍, 刘倩, 高娅妮, 柳旭. 植物对盐碱胁迫的响应机制研究进展. 生态学报, 2017, 37(16): 5565-5577. WANG Q Z, LIU Q, GAO Y N, LIU X. Review on the mechanisms of the response to salinity-alkalinity stress in plants. Acta Ecologica Sinica, 2017, 37(16): 5565-5577.
[35] 隆小华, 刘兆普, 郑青松, 徐文君. 不同浓度海水对菊芋幼苗生长及生理生化特性的影响(英文). 生态学报, 2005, 25(8): 1881-1889. LONG X H, LIU Z P, ZHENG Q S, XU W J. Effects of seawater with different concentrations on growth and physiological and biochemical characteristics of Helianthus tuberosus seedlings. Acta Ecologica Sinica, 2005, 25(8): 1881-1889.
[36] 张佩佩, 李文文, 吴玉环, 任晴雯, 陈瑞, 周蜜, 王熙予, 陈茹洁, 刘鹏. 水杨酸对菊芋耐高氯酸盐胁迫的影响. 水土保持学报, 2020, 34(4): 376-384. ZHANG P P, LI W W, WU Y H, REN Q W, CHEN R, ZHOU M, WANG X Y, CHEN R J, LIU P. Effect of exogenous salicylic acid on the tolerance of Helianthus tuberosus to ClO4− stress. Journal of Soil and Water Conservation, 2020, 34(4): 376-384.
[37] 黄晶, 孔亚丽, 吴龙龙, 张露, 朱练峰, 曹小闯, 朱春权, 张均华. 生物炭调控盐胁迫下水稻幼苗耐盐性能. 生态学杂志, 2021, 40(3): 627-634. HUANG J, KONG Y L, WU L L, ZHANG L, ZHU L F, CAO X C, ZHU C Q, ZHANG J H. Biochar regulates the salt tolerance of rice seedlings under salt stress. Chinese Journal of Ecology, 2021, 40(3): 627-634.
[38] 任怀新, 王冬梅, 王慧, 张泽洲, 刘若莎, 黄薇, 谢正丰. 生物炭对盐碱胁迫下黑麦草和紫花苜蓿光合及抗氧化特征的影响. 农业工程学报, 2021, 37(17): 116-123. REN H X, WANG D M, WANG H, ZHANG Z Z, LIU R S, HUANG W, XIE Z F. Effects of biochar on the photosynthetic and antioxidant characteristics of ryegrass and alfalfa under saline-alkali stress. Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(17): 116-123.
[39] 刘晓涵, 刘晓晖, 郑好, 荆永锋, 周文辉, 余海涛, 钱华, 叶协锋. 生物炭对烟草幼苗氯化钠胁迫的缓解效应. 中国烟草学报, 2022, 28(3): 52-62. LIU X H, LIU X H, ZHENG H, JING Y F, ZHOU W H, YU H T, QIAN H, YE X F. Alleviating effect of biochar on sodium chloride stress in tobacco seedlings. Acta Tabacaria Sinica, 2022, 28(3): 52-62.
[40] FARHANGI-ABRIZ S, TORABIAN S. Antioxidant enzyme and osmotic adjustment changes in bean seedlings as affected by biochar under salt stress. Ecotoxicology and Environmental Safety, 2017, 137: 64-70. doi: 10.1016/j.ecoenv.2016.11.029
-
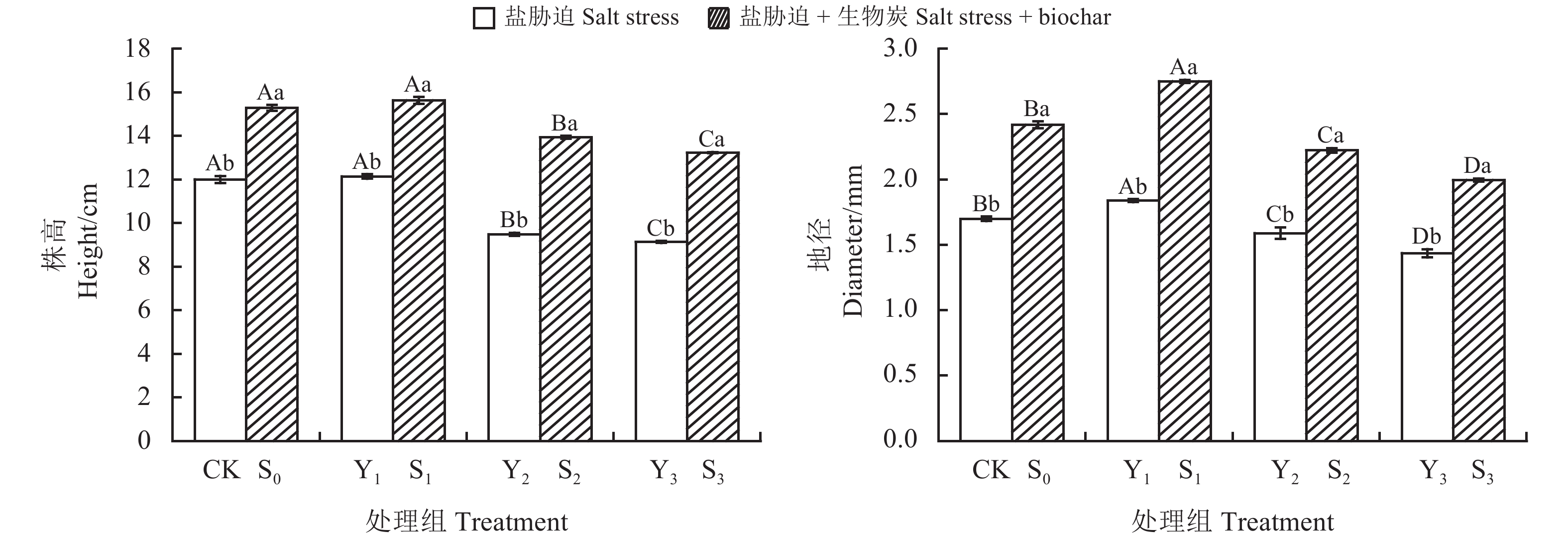
图 1 生物炭和不同水平盐胁迫下菊芋株高、地径的变化量
CK、S1、S2、S3和Y1、Y2、Y3同表1;不同大写字母表示盐处理和生物炭处理分别在不同浓度之间差异显著(P < 0.05),不同小写字母表示同一浓度下是否添加生物炭之间差异显著(P < 0.05);下同。
Figure 1. Effect of biochar on plant height and ground diameter of Helianthus tuberosus under salt stress
CK, S1, S2, S3, Y1, Y2, Y3 are same as them in Table 1; Different capital letters indicate significant differences between salt and biochar treatments at different concentrations at the 0.05 level, and different lowercase letters indicate significant differences between the same concentration with or without the addition of biochar at the 0.05 level. This is applicable for the following figures and tables as well.
表 1 试验处理分组
Table 1 Test treatment group
处理组
Treatment土壤含盐量
Soil salt content/(g·kg−1)生物炭
Biochar/%CK 0.00 0 Y1 1.67 0 Y2 3.35 0 Y3 5.02 0 S0 0.00 5 S1 1.67 5 S2 3.35 5 S3 5.02 5 -
[1] 杨劲松, 姚荣江, 王相平, 谢文萍, 张新, 朱伟, 张璐, 孙瑞娟. 中国盐渍土研究: 历程、现状与展望. 土壤学报, 2022, 59(1): 10-27. YANG J S, YAO R J, WANG X P, XIE W P, ZHANG X, ZHU W, ZHANG L, SUN R J. Research on salt-affected soils in China: History, status quo and prospect. Acta Pedologica Sinica, 2022, 59(1): 10-27.
[2] 唐雪, 尚辉, 刘广明, 姚宇阗, 张凤华, 杨劲松, 周龙祥, 储睿. 复合改良剂对盐碱土改良及植物生长的影响. 土壤, 2021, 53(5): 1033-1039. TANG X, SHANG H, LIU G M, YAO Y T, ZHANG F H, YANG J S, ZHOU L X, CHU R. Effects of combined amendment on improvement of salinized soil and plant growth. Soils, 2021, 53(5): 1033-1039.
[3] 孔涛, 吴祥云, 刘玲玲, 闫晗. 风沙地菊芋的主要生态学特性. 生态学杂志, 2009, 28(9): 1763-1766. KONG T, WU X Y, LIU L L, YAN H. Main ecological characteristics of jerusalem artichoke ( Helianthus tuberosus) in aeolian sandy land. Chinese Journal of Ecology, 2009, 28(9): 1763-1766.
[4] 吕晓, 徐慧, 李丽, 赵雲泰. 盐碱地农业可持续利用及其评价. 土壤, 2012, 44(2): 203-207. LYU X, XU H, LI L, ZHAO Y T. Agricultural sustainable utilization and evaluation of saline-alkali land. Soils, 2012, 44(2): 203-207.
[5] AHMAD M, RAJAPAKSHA A U, LIM J E, ZHANG M, BOLAN N, MOHAN D, VITHANAGE M, LEE S S, OK S Y. Biochar as a sorbent for contaminant management in soil and water: A review. Chemosphere, 2014, 99: 19-33. doi: 10.1016/j.chemosphere.2013.10.071
[6] 贾林, 张金龙, 刘璐瑶, 王鹏山, 李志明, 田晓明. 生物炭在盐碱区域土壤环境生态修复中的应用. 环境科学与技术, 2021, 44(S2): 124-131. JIA L, ZHANG J L, LIU L Y, WANG P S, LI Z M, TIAN X M. Biochar in the saline-alkali soil environment application in ecological restoration. Environmental Science & Technology, 2021, 44(S2): 124-131.
[7] 刘旭, 白一茹, 马娴, 王幼奇. 生物炭对黄绵土水分吸渗特征及水力学参数的影响. 干旱区资源与环境, 2023, 37(3): 77-84. LIU X, BAI Y R, MA X, WANG Y Q. Effects of biochar on water absorption characteristics and hydraulic parameters of loessial soil. Journal of Arid Land Resources and Environment, 2023, 37(3): 77-84.
[8] 熊钰婷, 袁旭音, 周慧华, 高一丹, 汪宜敏. 生物炭添加对太湖滨岸带土壤氮矿化和淋失特征的影响. 环境科学, 2022, 43(2): 762-769. XIONG Y T, YUAN X Y, ZHOU H H, GAO Y D, WANG Y M. Effects of biochar addition on soil nitrogen mineralization and leaching characteristics in riparian zone of Taihu Lake. Environmental Science, 2022, 43(2): 762-769.
[9] SUN H, LU H, CHU L, SHAO H, SHI W. Biochar applied with appropriate rates can reduce N leaching, keep N retention and not increase NH3 volatilization in a coastal saline soil. Science of The Total Environment, 2017, 575: 820-825. doi: 10.1016/j.scitotenv.2016.09.137
[10] WANG S B, GAO P L, ZHANG Q W, SHI Y L, GUO X L, LV Q X, WU W, ZHANG X, LI M Z, MENG Q M. Biochar improves soil quality and wheat yield in saline-alkali soils beyond organic fertilizer in a 3-year field trial. Environmental Science and Pollution Research, 2023, 30(7): 19097-19110.
[11] YUAN P, WANG J Q, PAN Y J, SHEN B X, WU C F. Review of biochar for the management of contaminated soil: Preparation, application and prospect. Science of The Total Environment, 2019, 659: 473-490. doi: 10.1016/j.scitotenv.2018.12.400
[12] 李思源, 饶良懿. 水淹胁迫对饲料桑苗( Morus alba)生长及渗透调节物质的影响. 生态学杂志, 2022, 41(10): 1873-1880. LI S Y, RAO L Y. Effects of waterlogging stress on the growth and osmotic adjustment substances in the seeding of forage mulberry. Chinese Journal of Ecology, 2022, 41(10): 1873-1880.
[13] 薛延丰, 刘兆普. 利用叶绿素荧光参数筛选抗盐菊芋品种的初步研究. 高技术通讯, 2008, 18(7): 766-770. doi: 10.3772/j.issn.1002-0470.2008.07.020 XUE Y F, LIU Z P. A preliminary study of screening salt-resistive varieties of Helianthus tuberosus L. using chlorophyll fluorescence parameters. Chinese High Technology Letters, 2008, 18(7): 766-770. doi: 10.3772/j.issn.1002-0470.2008.07.020
[14] 吴成龙, 周春霖, 尹金来, 刘兆普, 徐阳春, 沈其荣. NaCl胁迫对菊芋幼苗生长及其离子吸收运输的影响. 西北植物学报, 2006(11): 2289-2296. doi: 10.3321/j.issn:1000-4025.2006.11.016 WU C L, ZHOU C L, YIN J L, LIU Z P, XU Y C, SHEN Q R. NaCl stress on the growth, ion uptake and transport of Helianthus tuberosus seedlings. Acta Botanica Boreali-Occidentalia Sinica, 2006(11): 2289-2296. doi: 10.3321/j.issn:1000-4025.2006.11.016
[15] 王磊, 隆小华, 孟宪法, 刘兆普, 罗以筛. 不同形态氮素配比对盐胁迫下菊芋幼苗生理的影响. 生态学杂志, 2011, 30(2): 255-261. WANG L, LONG X H, MENG X F, LIU Z P, LUO Y S. Effects of different ratios of mineral nitrogen form on Helianthus tuberosus seedlings physiology under salt stress. Chinese Journal of Ecology, 2011, 30(2): 255-261.
[16] 任智新, 史建楠, 何佳星, 王晔, 范希峰, 李润枝, 于春欣, 彭真, 高月荣, 段留生. 盐胁迫对青绿苔草生长及生理特性的影响. 草地学报, 2022, 30(8): 2045-2052. REN Z X, SHI J N, HE J X, WANG Y, FAN X F, LI R Z, YU C X, PENG Z, GAO Y R, DUAN L S. Effects of salt stress on growth and physiological characteristics of carex leucochlora. Acta Agrestia Sinica, 2022, 30(8): 2045-2052.
[17] JAISWAL A K, ELAD Y, PAUDEL I, GRABER E R, CYTRYN E, FRENKEL O. Linking the belowground microbial composition, diversity and activity to soilborne disease suppression and growth promotion of tomato amended with biochar. Scientific Reports, 2017, 7(1): 44382. doi: 10.1038/srep44382
[18] HE L L, ZHAO J, YANG S M, ZHOU H, WANG S Q, ZHAO X, XING G X. Successive biochar amendment improves soil productivity and aggregate microstructure of a red soil in a five-year wheat-millet rotation pot trial. Geoderma, 2020, 376: 114570. doi: 10.1016/j.geoderma.2020.114570
[19] 齐琪, 马书荣, 徐维东. 盐胁迫对植物生长的影响及耐盐生理机制研究进展. 分子植物育种, 2020, 18(8): 2741-2746. QI Q, MA S R, XU W D. Advances in the effects of salt stress on plant growth and physiological mechanisms of salt tolerance. Molecular Plant Breeding, 2020, 18(8): 2741-2746.
[20] 徐福乐, 罗立津, 高灿红. 植物生长调节剂对甜椒的抗寒性诱导效应研究. 农药学学报, 2011, 13(1): 33-39. doi: 10.3969/j.issn.1008-7303.2011.01.06 XU F L, LUO L J, GAO C H. Inducing effects of plant growth regulators on the chilling resistance of sweet pepper ( Capsicum annuum). Chinese Journal of Pesticide Science, 2011, 13(1): 33-39. doi: 10.3969/j.issn.1008-7303.2011.01.06
[21] 姚佳, 刘信宝, 崔鑫, 李志华. 不同NaCl胁迫对苗期扁蓿豆渗透调节物质及光合生理的影响. 草业学报, 2015, 24(5): 91-99. YAO J, LIU X B, CUI X, LI Z H. Effects of NaCl stress on substances linked to osmotic adjustment and on photosynthetic physiology of Melilotoides ruthenicain the seedling stage. Acta Prataculturae Sinica, 2015, 24(5): 91-99.
[22] 丁理成, 王尧, 李景刚, 王庆华, 王延玲. 盐肤木与泰山盐肤木幼苗对盐胁迫的生理响应. 植物生理学报, 2022, 58(7): 1335-1345. DING L C, WANG Y, LI J G, WANG Q H, WANG Y L. Physiological response of Rhus chinensis and R. taisanensis seedlings to salt stress. Plant Physiology Journal, 2022, 58(7): 1335-1345.
[23] 王磊, 隆小华, 郝连香, 刘兆普. 氮素形态对盐胁迫下菊芋幼苗PSⅡ光化学效率及抗氧化特性的影响. 草业学报, 2012, 21(1): 133-140. WANG L, LONG X H, HAO L X, LIU Z P. Effects of nitrogen form on the photochemical efficiency of PSⅡ and antioxidant characteristics of jerusalem artichoke seedling under salt stress. Acta Prataculturae Sinica, 2012, 21(1): 133-140.
[24] IQBAL N, UMAR S, KHAN N A, KHAN M I. A new perspective of phytohormones in salinity tolerance: Regulation of proline metabolism. Environmental and Experimental Botany, 2014, 100: 34-42. doi: 10.1016/j.envexpbot.2013.12.006
[25] 段海霞, 邹恭鲁, 杨永鑫, 李颖, 吕世奇, 孙杉, 赵长明. 两种基因型菊芋幼苗对盐胁迫的生长及生理响应. 干旱地区农业研究, 2018, 36(3): 176-183. DUAN H X, ZOU G L, YANG Y X, LI Y, LYU S Q, SUN S, ZHAO Z M. Growth and physiological responses of two genotypes jerusalem artichoke ( Helianthus tuberosus) seedlings under salt stress. Agricultural Research in the Arid Areas, 2018, 36(3): 176-183.
[26] 冯大伟, 张洪霞, 刘广洋, 靳志明, 刘胜一, 衣悦涛. 黄河三角洲盐胁迫对不同品种菊芋幼苗生长及生理特性的影响. 中国农学通报, 2013, 29(36): 155-159. FENG D W, ZHANG H X, LIU G Y, JIN Z M, LIU S Y, YI Y T. Effects of salt stresses on the growth and physiological characteristics of Helianthus tuberosus seedlings in yellow river delta. Chinese Agricultural Science Bulletin, 2013, 29(36): 155-159.
[27] EKINCI M, TURAN M, YILDIRIM E. Biochar mitigates salt stress by regulating nutrient uptake and antioxidant activity, alleviating the oxidative stress and abscisic acid content in cabbage seedlings. Turkish Journal of Agriculture and Forestry, 2022, 46(1): 28-37.
[28] HAFEZ Y, ATTIA K, ALAMERY S, GHAZY A, AL-DOSS A, IBRAHIM E, RASHWAN E, EI-MAGHRABY L, AWAD A, ABDELAAL K. Beneficial effects of biochar and chitosan on antioxidative capacity, osmolytes accumulation, and anatomical characters of water-stressed barley plants. Agronomy, 2020, 10(5): 630. doi: 10.3390/agronomy10050630
[29] MUNNS R, TESTER M. Mechanisms of Salinity Tolerance. Annual Review of Plant Biology, 2008, 59(1): 651-681. doi: 10.1146/annurev.arplant.59.032607.092911
[30] AKHTAR S S, ANDERSEN M N, LIU F. Biochar Mitigates Salinity Stress in Potato. Journal of Agronomy and Crop Science, 2015, 201(5): 368-378. doi: 10.1111/jac.12132
[31] AKHTAR S S, ANDERSEN M N, LIU F. Residual effects of biochar on improving growth, physiology and yield of wheat under salt stress. Agricultural Water Management, 2015, 158: 61-68. doi: 10.1016/j.agwat.2015.04.010
[32] 张金林, 李惠茹, 郭姝媛, 王锁民, 施华中, 韩庆庆, 包爱科, 马清. 高等植物适应盐逆境研究进展. 草业学报, 2015, 24(12): 220-236. ZHANG J L, LI H R, GUO S Y, WANG S M, SHI H Z, HAN Q Q, BAO A K, MA Q. Research advances in higher plant adaptation to salt stress. Acta Prataculturae Sinica, 2015, 24(12): 220-236.
[33] 毛恋, 芦建国, 江海燕. 植物响应盐碱胁迫的机制. 分子植物育种, 2020, 18(10): 3441-3448. MAO L, LU J G, JIANG H Y. Mechanisms of plant responses to salt-alkali stress. Molecular Plant Breeding, 2020, 18(10): 3441-3448.
[34] 王佺珍, 刘倩, 高娅妮, 柳旭. 植物对盐碱胁迫的响应机制研究进展. 生态学报, 2017, 37(16): 5565-5577. WANG Q Z, LIU Q, GAO Y N, LIU X. Review on the mechanisms of the response to salinity-alkalinity stress in plants. Acta Ecologica Sinica, 2017, 37(16): 5565-5577.
[35] 隆小华, 刘兆普, 郑青松, 徐文君. 不同浓度海水对菊芋幼苗生长及生理生化特性的影响(英文). 生态学报, 2005, 25(8): 1881-1889. LONG X H, LIU Z P, ZHENG Q S, XU W J. Effects of seawater with different concentrations on growth and physiological and biochemical characteristics of Helianthus tuberosus seedlings. Acta Ecologica Sinica, 2005, 25(8): 1881-1889.
[36] 张佩佩, 李文文, 吴玉环, 任晴雯, 陈瑞, 周蜜, 王熙予, 陈茹洁, 刘鹏. 水杨酸对菊芋耐高氯酸盐胁迫的影响. 水土保持学报, 2020, 34(4): 376-384. ZHANG P P, LI W W, WU Y H, REN Q W, CHEN R, ZHOU M, WANG X Y, CHEN R J, LIU P. Effect of exogenous salicylic acid on the tolerance of Helianthus tuberosus to ClO4− stress. Journal of Soil and Water Conservation, 2020, 34(4): 376-384.
[37] 黄晶, 孔亚丽, 吴龙龙, 张露, 朱练峰, 曹小闯, 朱春权, 张均华. 生物炭调控盐胁迫下水稻幼苗耐盐性能. 生态学杂志, 2021, 40(3): 627-634. HUANG J, KONG Y L, WU L L, ZHANG L, ZHU L F, CAO X C, ZHU C Q, ZHANG J H. Biochar regulates the salt tolerance of rice seedlings under salt stress. Chinese Journal of Ecology, 2021, 40(3): 627-634.
[38] 任怀新, 王冬梅, 王慧, 张泽洲, 刘若莎, 黄薇, 谢正丰. 生物炭对盐碱胁迫下黑麦草和紫花苜蓿光合及抗氧化特征的影响. 农业工程学报, 2021, 37(17): 116-123. REN H X, WANG D M, WANG H, ZHANG Z Z, LIU R S, HUANG W, XIE Z F. Effects of biochar on the photosynthetic and antioxidant characteristics of ryegrass and alfalfa under saline-alkali stress. Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(17): 116-123.
[39] 刘晓涵, 刘晓晖, 郑好, 荆永锋, 周文辉, 余海涛, 钱华, 叶协锋. 生物炭对烟草幼苗氯化钠胁迫的缓解效应. 中国烟草学报, 2022, 28(3): 52-62. LIU X H, LIU X H, ZHENG H, JING Y F, ZHOU W H, YU H T, QIAN H, YE X F. Alleviating effect of biochar on sodium chloride stress in tobacco seedlings. Acta Tabacaria Sinica, 2022, 28(3): 52-62.
[40] FARHANGI-ABRIZ S, TORABIAN S. Antioxidant enzyme and osmotic adjustment changes in bean seedlings as affected by biochar under salt stress. Ecotoxicology and Environmental Safety, 2017, 137: 64-70. doi: 10.1016/j.ecoenv.2016.11.029



 下载:
下载: