第一作者:车建美(1977-),女,山东乳山人,副研究员,博士,研究方向为微生物生物技术。E-mail:[email protected]
为了探讨菌渣对黑麦草( Lolium perenne)根际土壤微生物群落结构的影响,测定了添加不同量菌渣后黑麦草根际土壤的磷脂脂肪酸(phospholipid fatty acids,PLFAs),比较分析了不同处理下黑麦草根际土壤微生物PLFAs组成、相对含量和微生物群落结构的差异。结果表明,施用菌渣后,黑麦草植株根际土壤微生物磷脂脂肪酸生物标记种类和总量均高于对照组。进一步分析表明,菌渣处理可以改变黑麦草根际土壤微生物种群结构,有利于根际土壤中细菌、真菌和放线菌的生长。同时,采用菌渣处理黑麦草后,其根际土壤微生物群落的Simpson、Shannon-Wiener和Pielou指数均得以提高,表明菌渣可以增加黑麦草根际土壤中微生物群落多样性,推测其可以改善根际土壤质量。
The present study dealt with the effect of the edible fungus residue on the ecological characteristics of microorganism fatty acids in the rhizosphere of ryegrass. The phospholipid fatty acids (PLFAs) of the soil samples were detected by GC of Agilent 6890N. Pattern, content and structure of the microbial PLFAs in ryegrass rhizosphere were evaluated. The results showed that the types and content of microbial PLFAs in the rhizosphere of ryegrass adding edible fungus residue were higher than those in the control. In further, the microbial population structure could be changed due to improving the growth of bacteria, fungi and actinomycetes by the treatments with adding edible fungus residue. The edible fungus residue could increase the microbial community diversity in the soil, in which, the enhancement of Shannon-Wiener index of community dominance, Simpson index of community abundance and Pielou index of uniformity was revealed. It was guessed that the quality of rhizosphere soil could be improved by adding edible fungus residue.
菌渣是栽培食用菌后的培养料, 主要包括木屑、棉籽壳、玉米芯及作物秸秆等食用菌分解吸收后残留的粗物质、食用菌代谢产物以及部分菌丝体[1]。随着食用菌产业的发展, 菌渣的数量急剧增加, 据中国食用菌协会统计, 2008年的食用菌产量1 830万t, 菌渣4 570万t; 福建省2009年食用菌产量约197万t, 菌渣约492万t, 而菌渣的利用率仅有33%, 一方面造成了资源的极大浪费, 另一方面霉菌和害虫的生长, 增加了空气中霉菌孢子和害虫的数量, 造成空气污染[2, 3, 4, 5]。
目前, 对菌渣的利用研究主要集中于以下几个方面:1)用作农作物基肥, 能够增加土壤的通透性、改善理化性质, 提高作物品质, 增产增效[6]; 2)用作栽培基质, 可降低成本, 提高作物产量和品质[7]; 3)用作燃料, 用于菌种生产和熟料栽培时的灭菌燃料[8]; 4)用作饲料添加剂[9]; 5)用作原料基质再利用[10]。施入菌渣肥可提高柑橘(Citrus reticulata)果园土壤平均有机碳矿化速率, 增加有机碳的积累[11]。菌渣有机肥可替代化肥在油菜(Brassica campestris)上做基肥施用, 能够促进油菜增产, 菌渣有机肥配合化肥使用效果较好, 每亩(667 m2)施用菌渣有机肥300 kg和复合肥25 kg的处理最佳, 比农民习惯施肥增产24.6%, 效益提高21.5%[12]。菌渣处理对小麦(Triticum aestivum)株高、总干物质量和穗粒数有连续稳定的促进作用, 并且与牛粪的配合施用效果更佳[13]。添加香菇(Lentinus edodes)菌渣可以不同程度地提高土壤真菌和放线菌数量, 同时可以增强几丁质酶活性和脱氢酶活性[14]。可见, 菌渣的利用价值非常高。目前, 菌渣在果树、蔬菜和水稻(Oryza sativa)上的应用较多, 在牧草种植方面的应用较少, 同时, 菌渣对土壤微生态环境影响效果方面的详细研究还远远不足。
不同微生物具有不同的特征脂肪酸[15]。土壤中磷脂脂肪酸(phospholipid fatty acids, PLFAs)的组成可以表示土壤微生物群落的结构[16]。采用PLFAs生物标记法分析发现, PLFAs含量与水稻有效穗数和产量呈显著正相关关系[17], 大豆(Giycine max)的根际土壤微生物多样性高于栽培草地和玉米(Zea mays)的[18]。但目前基于PLFAs分析菌渣对牧草根际土壤微生物群落的研究尚未见报道。因此, 本研究采用PLFAs法分析了菌渣施用对黑麦草(Lolium perenne)根际土壤微生物群落的影响, 扩大了菌渣的应用范围, 有利于科学合理地利用菌渣, 减轻菌渣对环境的危害, 可为菌渣与种植业肥源有效衔接以及菌渣在生态农业中的广泛利用提供理论依据。
牧草品种为速达黑麦草; 黑麦草和双孢菇菌渣(主要原料为水稻秸秆和牛粪等)均由福建省农业科学院农业生态研究所提供。供试菌渣的化学性质见参考文献[11]。
1.2.1 菌渣的施用和取样方法 采用盆栽苗进行试验。底肥:将NaH2PO4、KCl和MgSO4按照培养用土施用基肥P、K和Mg分别为40、50和25 kg· hm-2换算后与土壤混合使用。施肥水平设为5个处理, 分别用CK1、CK2、T1、T2和T3表示。CK1施尿素量200 kg· hm-2(相当于纯氮量93.34 kg· hm-2)、CK2施尿素量为0; T1、T2和T3则为将菌渣按照相应的含氮量进行施用的处理:T1相当于施纯氮量100 kg· hm-2, T2相当于施纯氮量200 kg· hm-2, T3相当于施纯氮量300 kg· hm-2。每个处理18盆(外口径34 cm, 内口径29 cm, 高23 cm), 每盆10 kg, 均匀种植10株牧草[5, 6], 生长阶段为叶丛期。牧草按照日常管理进行。在种植10、30、60、90和120 d时进行取样, 每个处理取3盆, 将牧草轻轻拔出, 抖掉大部分土壤, 只留根部土壤, 过孔径为420 μ m筛后进行总体脂肪酸提取。
1.2.2 磷脂脂肪酸(PLFAs)的提取和检测方法 参考Frosteg
1.2.3 数据分析 利用PLFAs的种类和含量, 对菌渣施用后黑麦草根际微生物群落进行分析, 其中, 微生物总量为所有PLFAs标记的总量和; 采用16:0作为细菌的特征脂肪酸[22], 其含量指示土壤细菌的含量; 18:1ω 9с 作为真菌的特征脂肪酸[19], 其含量指示土壤真菌的含量, 10Me17:0作为放线菌的特征脂肪酸[23], 其含量指示土壤放线菌的含量, 对这三大类微生物含量在黑麦草根际土壤分布的差异性进行比较, 分析菌渣对黑麦草根际土壤特征微生物分布动态的影响。采用单因子方差分析进行不同处理组PLFAs含量的显著性分析, 所用软件为DPS 7.05。
微生物群落多样性指数:按照计算物种指数的方法计算菌渣处理后黑麦草根际土壤微生物群落生态学多样性指数Shannon-Wiener(H')、均匀度指数Pielou(E)和优势度指数Simpson(C)[21]:
H'=-∑ PilnPi;
E=H/lnS;
C=1-∑ (ni/N)2.
式中:S为微生物群落中脂肪酸总的种类数, Pi=ni/N, ni为i类脂肪酸的个数, N为本研究中总脂肪酸个数[21]。
施用菌渣后10和30 d时, 处理组T1、T2和T3黑麦草植株根际土壤微生物PLFAs种类显著高于CK1和CK2组(P< 0.05)。在培养60、90 d时, 处理组T3黑麦草植株根际土壤微生物PLFAs种类显著高于CK1组(P< 0.05)。CK2组黑麦草植株根际土壤微生物PLFAs种类最少, 其变化范围为25~36种。T1、T2和T3处理组的PLFAs标记种类也有所不同, 其变化范围分别为37~43, 40~47和42~52种。各处理平均PFLAs种类多少依次表现为T3(45.6种)> T2(42.2种)> T1(40.4种)> CK1(32.6种)> CK2(31.6种)(图1)。
施用菌渣后60-120 d, T1、T2和T3组黑麦草植株根际土壤微生物PLFAs总量显著高于CK1和CK2组(P< 0.05), PLFAs总含量在8.78~15.65 mg· g-1; CK1组PLFAs生物总量变化幅度为3.35~6.39 mg· g-1, CK2组PLFAs生物总量变化幅度为2.69~7.69 mg· g-1。在菌渣施用后的30-120 d, T3组PLFAs总量均显著高于T1和T2处理组(P< 0.05), 变化幅度在10.24~15.65 mg· g-1, 说明随着菌渣添加量的增多, PLFAs总量也增加(图2)。
菌渣施用对黑麦草植株根际土壤细菌的影响较大。在菌渣施用10-90 d时, CK1和CK2处理组根际土壤细菌PLFAs含量的变化趋势为持续升高。在培养90 d时, CK1和CK2处理组根际土壤细菌PLFAs含量最高, 分别为0.96和1.05 mg· g-1。在培养10、30、60和120 d时, 处理组T1、T2和T3根际土壤的细菌PLFAs含量显著高于对照组的(P< 0.05)。在120 d时, 处理组T1和T2根际土壤细菌PLFAs含量达到最高, 分别为2.31和2.78 mg· g-1。在整个培养周期内, 施用菌渣T3处理根际土壤细菌PLFAs平均含量最高, 是空白对照CK2组的3.38倍, 是化肥处理CK1组的3.61倍(图3)。
在采样期间(10-120 d), 不同菌渣处理后, 黑麦草植株根际土壤真菌PLFAs含量变化趋势有所不同。T1处理组真菌含量在120 d时达到最大, 为2.41 mg· g-1, T2处理组真菌含量在60 d时达到最大, 为1.55 mg· g-1, T3处理组真菌含量在90 d时达到最大, 为3.01 mg· g-1(图4)。各处理黑麦草根际土壤真菌PLFAs平均含量依次表现为T3> T2> T1> CK2> CK1。
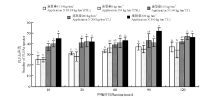
不同菌渣处理对黑麦草植株根际土壤放线菌PLFAs含量的影响不同。在黑麦草的整个生长期中, T1、T2和T3处理组均可以检测到放线菌, CK2处理组仅在120 d时检测到放线菌, CK1组在60 d和90 d时可检测到放线菌, 但是其它时期则检测不到(图5)。
 | 图5 菌渣对黑麦草植株根际土壤放线菌PLFAs含量的影响Fig.5 Effects of edible fungus residue on the soil actinomycetes PLFAs content of rgegrass rhizosper |
T1、T2和T3处理组放线菌含量显著高于CK1和CK2(P< 0.05), T1和T2处理组放线菌含量在120 d时达到最大, 分别为0.86和1.91 mg· g-1, T3处理组放线菌含量在90 d时达到最大, 为1.77 mg· g-1。各处理黑麦草根际土壤放线菌PLFAs平均含量依次表现为T3> T2> T1> CK1> CK2。
多样性指数是土壤微生物群落多样性的主要评价指标, 与微生物群落多样性呈正相关关系[21]。菌渣处理后, 随着培养时间的延长, 在培养至120 d时, 黑麦草根际土壤微生物群落的Simpson、Shannon-Wiener和Pielou指数有所提高, 在整个采样周期内, T1、T2和T3的平均Simpson指数分别比CK1提高了13.33%、13.33%和17.33%, 比CK2提高了18.06%、18.06%和22.22%。T1、T2和T3的平均Shannon-Wiener指数分别比CK1提高了21.66%、22.93%和26.75%, 比CK2提高了25.25%、26.56%和30.49%。T1、T2和T3的平均Pielou指数均比CK1提高了14.29%, 比CK2提高了18.03%(表1)。
| 表1 不同菌渣处理黑麦草根际土壤微生物群落多样性指数 Table 1 Soil microbial species index of ryegrass rhizosphere under adding edible fungus residue |
土壤中的微生物群落一直处于动态平衡中, 影响土壤的理化因子都会干扰土壤微生物群落的平衡, 从而影响土壤微生物的活性及其生态功能, 进而影响土壤肥力、土壤环境质量及健康[24]。影响土壤微生物的因素很多, 包括作物根际分泌物、外界环境及施肥种类等[25, 26, 27, 28]。与化肥相比, 有机肥处理更能提高土壤中微生物的活性[29], 有机农业土壤的微生物活性比常规农业更高[30]。本研究发现, 施用菌渣后的黑麦草植株根际土壤微生物PLFAs种类和总量均高于对照组。与此相似, 江西永丰县官山林场, 39%矿渣肥处理组的毛竹(Phyllostachys heterocycla cv. pubescens)根际土壤平均总PLFAs含量最高, 毛竹专用肥处理次之, 其次分别为45%矿渣肥处理和不施肥对照[31]。菌渣的施用可以提高黑麦草根际土壤微生物的种类和总含量, 这将有利于维持微生物的多样性, 从而可能会进一步影响根际土壤肥力。
根际土壤微生物功能多样, 可以分解土壤有机质、转化无机质、固氮等, 从而利于植物养分吸收, 促进植株生长, 提高抗病能力[32, 33]。本研究发现, 菌渣处理后可以改变黑麦草根际土壤微生物种群结构和含量, 有利于根际土壤中细菌、真菌和放线菌的生长。同样, 将出菇后的菌渣归还梨园土壤, 与对照(无菌渣)相比, 0-40 cm土层细菌数量提高12.1%~47.0%, 放线菌数量提高19.5%~82.8%, 真菌数量68.7%~163.6%[34]。不同菌渣肥施用量可提高柑橘(Citrus reticulata)园的微生物活性, 增加果园土壤有机碳的积累[11]。在土壤中添加不同质量分数的香菇菌渣对土壤微生物数量也有不同程度的提高作用, 其中真菌和放线菌数量均随添加量的增加而增大, 从根本上有利于土壤质量的改善[14]。本研究发现, 随着菌渣添加量的增加, 土壤中细菌、真菌和放线菌的数量也增加, 因而推测菌渣添加量的增加有利于改善黑麦草根际土壤质量, 从而促进植株的生长, 菌渣如何改变黑麦草根际土壤的性状, 还有待于进一步研究。
土壤微生物的代谢特征、多样性及不饱和脂肪酸的相对丰度可以通过向土壤中添加简单有机物来改变[24, 35, 36]。厩肥、绿肥等可以使土壤微生物的多样性及活性维持较高的水平[24, 36, 37]。菌渣可作为有机肥料或土壤改良剂, 因而在农业生产上具有较高的利用价值[24, 36, 38, 39]。目前, 关于菌渣对土壤生物性质的影响已有相关研究[40], 但关于其对土壤微生物群落结构的丰富度及均匀度影响方面的研究则比较少。在多样性指数中, Simpson指数反映群落的优势度, Shannon指数反映群落的丰富度, Pielou指数反映群落物种均匀度[21, 41, 42]。本研究表明, 黑麦草施用菌渣后, 其根际土壤微生物群落的Simpson、Shannon-Wiener和Pielou指数值均得以不同程度的提高, 表明施用菌渣后可以提高黑麦草根际土壤中微生物群落结构和组成的丰富度和均匀性, 使得土壤生态系统趋于稳定, 对不利影响的缓冲性更好。前人研究表明, 当土壤微生物群落结构越丰富, 物种越均匀, 多样性越高时, 越有利于植株抵御外界干扰[43, 44]。因而, 推测施用菌渣有利于进一步增强植株抵御病害能力。
不同种类食用菌菌渣理化性质有所不同, 对不同土壤类型和不同种植作物产生的施用效果也可能不同。同时, 施用菌渣后, 对所种植作物生长特性、产量及品质的影响, 还需要进一步研究与评估。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|