第一作者:严俊鑫(1981-),女,黑龙江哈尔滨人,副教授,博士,主要从事园林植物抗逆性研究。E-mail:[email protected]
本研究在模拟正常水分、中度干旱、重度干旱条件下对肥皂草( Saponaria officinalis)施加不同浓度的硅,测定其叶片光合指标及叶绿素含量,并对光响应曲线进行拟合,明确各处理下的肥皂草叶片的光响应参数。结果表明,施硅使正常水分条件下的光补偿点降低,其余各项指标均增高;施硅使两种干旱胁迫下的净光合速率、叶绿素含量、最大净光合速率、暗呼吸速率、光饱和点和表观量子效率等增高,气孔导度、蒸腾速率和光补偿点降低。其中0.3和0.4 g SiO2·kg-1干土硅添加处理效果较好。说明施硅可以使肥皂草光合呼吸作用加强,从而更好地利用光能和调节自身新陈代谢,并有效缓解干旱造成的损害。
Experiments was conducted by normal conditions, mild drought stress, severe drought stress and different concentrations of silicon treatment on Saponaria officinalis, and photosynthetic parameters and chlorophyll content of leaves were determined. The photosynthetic curve was fitted, and the photoresponse parameters under various treatments were obtained. The results showed that the light compensation point (LCP) of S. officinalis leaves decreased, and the rest of the photosynthetic physiological indexes increased by silicon application under normal condition; The net photosynthetic rate(Pn), chlorophyll content, maximum net photosynthetic rate(Amax), dark respiration rate(Rd), light saturation point (LSP) and apparent quantum efficiency(AQY) of S. officinalis leaves increased, and stomatal conductance(Gs), transpiration rate(Tr) and LCP decreased by silicon application under mild and severe drought stress. Notably, 0.3, 0.4 g SiO2·kg-1 were most effective. The results indicated that the application of silicon could enhance the photosynthesis and respiration of the S. officinalis, so as to make better use of the light energy and regulate the metabolism and significantly alleviate the damage caused by the drought.
我国是世界上主要的干旱国家之一, 干旱和半干旱地区面积为542万km2, 占国土总面积的56%。干旱胁迫作为植物逆境最普遍的形式, 其危害不容忽视。水作为植物代谢过程的介质, 是植物光合作用的原料, 光合作用的产物也同样需要通过水进行运输, 因此, 缺水会抑制植物的生长, 加速植物衰老, 降低光合速率[1]。园林绿化与养护过程中对水资源需求极大, 干旱限制了园林植物的应用, 影响了观赏效果, 提高园林植物的抗旱性可以在很大程度上减轻生态负担, 丰富园林景观。
硅是植物生长发育的有益元素, 通常土壤中含硅量为50%~70%, 但大部分以硅酸盐结晶或沉淀形式存在, 不能被植物吸收利用。高等植物主要以单硅酸(H4SiO4)形式吸收硅, 而土壤中能被植物吸收利用的有效硅数量极少, 一般为50~250 mg· kg-1 [2]。已有研究表明, 外源硅能够促进植物生长发育, 并提高植物的抗旱性[3, 4, 5, 6], 但是相关研究主要集中于作物和草坪植物, 而对于园林中观赏花卉施加硅的研究极少。
肥皂草(Saponaria officinalis)是石竹科(Caryophyllaceae)肥皂草属(Saponaria)多年生草本植物, 抗逆性较强、花期长, 是良好的园林绿化植物; 易繁殖, 耐修剪, 短期就能丰富园林景观, 适合作花坛、花境和岩石园栽植。目前, 肥皂草的相关研究主要集中在繁殖栽培与药用物质研究上[7, 8, 9, 10]。本研究通过对干旱胁迫条件下的肥皂草添加外源硅, 分析施硅对各梯度干旱胁迫条件下肥皂草光合参数的影响, 将为进一步研究硅对植物内部生理机能产生的作用提供参考, 也为科学配置旱区植物景观、丰富旱区绿化植物种类、优化园林植物日常养护管理等提供一定的理论依据。
本研究以二年龄的肥皂草为试验材料, 试验在东北林业大学苗圃内进行。2015年5月选取长势一致的肥皂草裸根苗移栽到上径25 cm、下径20 cm、高20 cm的圆形花盆中, 基质为蛭石和草炭土(体积比1∶ 3)。测得基质pH 5.84, 有效磷为63.35 mg· kg-1, 有效氮为96.45 mg· kg-1, 速效钾为187.34 mg· kg-1, 有效硅为129.19 mg· kg-1, 有机质为41.6 g· kg-1。试验以硫酸钾为基肥, 硅酸钾(K2SiO4)作硅肥, 加入硅酸钾所引入的钾量从硫酸钾中扣除。基肥和硅肥一次性施入土壤, 混合均匀。试验设4个硅处理水平:0.1 g SiO2· kg-1干土(Si1), 0.2 g SiO2· kg-1干土(Si2), 0.3 g SiO2· kg-1干土(Si3), 0.4 g SiO2· kg-1干土(Si4), 以不施硅为对照(CK)。
2015年6月, 采用自然干旱法对水分进行控制, 土壤含水量的测定采用称重法[5, 6], 控制在3个梯度, 分别是正常T1(土壤田间持水量的80%~90%)、中度胁迫T2(土壤田间持水量的50%~65%)、重度胁迫T3(土壤田间持水量的30%~45%)。土壤相对含水量达到干旱胁迫条件时, 称重补水使水分保持在相应梯度。于满足水分条件后的1、5、10、15和20 d选择成熟健康的植株叶片对光合指标进行测定, 并采集叶片于液氮中速冻后放入-80 ℃冰箱保存, 以备叶绿素含量的测定。于第7天测定光响应, 每处理3个重复, 最终分析每种水分条件下不同硅处理之间的差异。
叶片光合指标的测定:采用LI-COR公司生产的便携式光合仪LI-6400于09:00-11:00, 在天气晴朗无风条件下, 以自然光为光源, 此时测得环境光合有效辐射为850~1 000 μ mol· (m2· s)-1, 大气CO2浓度为370~380 μ mol· mo-1, 用标准叶室测定净光合速率[Pn, μ mol· (m2· s)-1]、蒸腾速率[Tr, mmol· (m2· s)-1]和气孔导度[Gs, mol· (m2· s)-1]等参数。
叶绿素含量的测定:采用丙酮法[11]。
叶片光响应曲线的测定:利用LI-COR公司生产的便携式光合仪LI-6400, 在晴天 09: 00-11:00选取3~5片长势一致的成熟叶片进行测定。测定时采用开放气路, CO2浓度保持在370~380 μ mol· mo-1, 流速为500 μ mol· s-1, 光强由红蓝LED光源进行控制, 依次设定光合有效辐射强度(PAR)为2 000、1 800、1 600、1 400、1 200、1 000、800、600、400、200、100、50、25、10和0 μ mol· (m2· s)-1。采用非直角双曲线模型[12]对光响应曲线进行拟合。计算出最大净光合速率 (Amax, maximum assimilation rate)、暗呼吸速率(Rd, apparent dark respiration rate)。对光响应曲线的初始部分[PAR ≤ 200 μ mol· (m2· s)-1] 进行线性回归[13], 得出表观量子效率 (AQY, apparent quantum yield), 并计算出光饱和点(LSP, light saturation point)、光补偿点(LCP, light compensation point)[14]。
数据采用SPSS 19.0软件进行统计分析, 用平均值± 标准误表示测定结果, 对处理结果进行单因素方差分析, 并用Duncan法对各测定数据进行多重比较; 用非线性回归和线性回归对光响应曲线进行拟合; 用Excel 2010软件进行制图。
2.1.1 叶片净光合速率 T1条件下, 0.1和0.2 g· kg-1硅处理与对照(CK)的肥皂草叶片Pn稳定在9~11 μ mol· (m2· s)-1内, 0.3和0.4 g· kg-1硅处理则在10~13 μ mol· (m2· s)-1内。随着硅浓度的增加, 每个时间点的肥皂草叶片Pn呈现上升趋势, 各处理叶片Pn均高于CK, 其中0.1 g· kg-1硅处理(Si1)较CK提高了0~9%, 0.2 g· kg-1硅处理(Si2)较CK提高了6%~15%, 0.3 g· kg-1硅处理(Si3)较CK提高了13%~25%, 0.4 g· kg-1硅处理(Si4)比CK提高了16%~22%。0.3和0.4 g· kg-1硅处理的植株叶片Pn在第5天以后显著高于CK(P< 0.05), 分别在第10天和第20天达到12.03和11.45 μ mol· (m2· s)-1, 0.1 g· kg-1硅处理除第5天以外, 在其它时间点与CK相比差异均不显著(P> 0.05)(表1)。
| 表1 正常条件下(T1)硅处理对肥皂草叶片Pn [μ mol· (m2· s)-1]的影响 Table 1 Effects of Si on Pn [μ mol· (m2· s)-1] of S. officinalis leaves under normal condition |
T2条件下, 随着干旱天数的增加, 各处理的肥皂草叶片Pn呈下降趋势(表2)。随着硅浓度的增加, 每个时间点的叶片Pn呈现先上升后下降的趋势, 各处理叶片的Pn均高于CK, 0.1 g· kg-1硅处理较CK提高了1%~11%, 0.2 g· kg-1硅处理较CK提高了7%~17%, 0.3 g· kg-1硅处理较CK提高了20%~36%, 0.4 g· kg-1硅处理较CK提高了12%~26%。0.3 g· kg-1硅处理在每个时间点均显著高于CK(P< 0.05), 在第15天较CK提高了36.40%。0.1 g· kg-1硅处理在每个时间点与CK相比均差异不显著(P> 0.05)(表2)。
| 表2 中度干旱胁迫下(T2)硅处理对肥皂草叶片Pn [μ mol· (m2· s)-1]的影响 Table 2 Effects of Si on Pn [μ mol· (m2· s)-1] of S. officinalis leaves under mild drought stress |
T3条件下, 随着干旱天数的增加, 各处理下的叶片Pn仍呈下降趋势, 干旱胁迫后期下降值趋近于零。随着硅浓度的增加, 干旱胁迫前10 d肥皂草叶片Pn呈现先上升后下降的趋势, 干旱胁迫10 d后随硅浓度增加呈现上升趋势。各处理叶片的Pn均高于CK, 0.1 g· kg-1硅处理较CK提高了12%~33%, 0.2 g· kg-1硅处理较CK提高了15%~53%, 0.3 g· kg-1硅处理较CK提高了26%~73%, 0.4 g· kg-1硅处理较CK提高了25%~70%。除第1天外, 在其它时间点0.3和0.4 g· kg-1硅处理均显著高于CK(P< 0.05)(表3)。
| 表3 重度干旱胁迫下(T3)硅处理对肥皂草叶片Pn [μ mol· (m2· s)-1]的影响 Table 3 Effects of Si on Pn [μ mol· (m2· s)-1] of S. officinalis leaves under severe drought stress |
T1条件肥皂草叶片Pn下降不明显。T2、T3条件下, 随着干旱天数的增加, 肥皂草叶片Pn随着干旱强度的加剧显著降低。各个水分梯度下, 施硅对肥皂草
叶片Pn均有提升, 其中T3条件下0.3和0.4 g· kg-1硅处理在第20天较CK提高了70%多。
2.1.2 叶片气孔导度 T1条件下, 各处理的肥皂草叶片Gs随着时间的增加无明显下降趋势(表4)。各处理下的叶片Gs均高于CK, 且随着硅处理浓度的增加呈现先上升后下降趋势。0.1 g· kg-1硅处理较CK提高了3%~23%, 0.2 g· kg-1硅处理较CK提高了26%~52%, 0.3 g· kg-1硅处理较CK提高了50%~76%, 0.4 g· kg-1硅处理较CK提高了28%~61%。第5天以后, 0.3和0.4 g· kg-1硅处理均显著高于CK(P< 0.05)。0.1和0.2 g· kg-1硅处理前5 d与CK差异不显著(P> 0.05), 10-15 d, 0.2 g· kg-1硅处理显著高于CK(P< 0.05)(表4)。
| 表4 正常条件下(T1)硅处理对肥皂草叶片Gs [mol· (m2· s)-1]的影响 Table 4 Effects of Si on Gs [mol· (m2· s)-1] of S. officinalis leaves under normal condition |
T2条件下, 随着干旱天数的增加, 各处理的肥皂草叶片Gs呈下降趋势。施硅降低了叶片Gs, 在胁迫5-20 d各硅处理的降低效果尤为明显, 且随着硅处理浓度的增加呈先下降后上升趋势。0.1 g硅处理较CK降低了1%~19%, 0.2 g· kg-1硅处理较CK降低了9%~36%, 0.3 g· kg-1硅处理较CK降低了23%~49%, 0.4 g· kg-1硅处理较CK降低了9%~46%。其中0.3和0.4 g硅处理在每个时间点均显著低于CK(P< 0.05), 而0.1和0.2 g· kg-1硅处理分别在第10天和第5天显著低于CK(P< 0.05)(表5)。
T3条件下, 随着干旱天数的增加, 各处理的肥皂草叶片Gs呈下降趋势。在胁迫前15 d, 施硅降低了叶片Gs, 且随着硅处理浓度的增加呈现先下降后上升趋势, 其中0.1 g· kg-1硅处理较CK降低了3%~21%, 0.2 g· kg-1硅处理较CK降低了16%~36%, 0.3 g· kg-1硅处理较CK降低了27%~50%, 0.4 g· kg-1硅处理较CK降低了20%~50%。在胁迫20 d时, 各处理与CK相比差异不显著(P> 0.05)(表6)。
| 表5 中度干旱胁迫下(T2)硅处理对肥皂草叶片Gs [mol· (m2· s)-1]的影响 Table 5 Effects of Si on Gs [mol· (m2· s)-1] of S. officinalis leaves under mild drought stress |
| 表6 重度干旱胁迫下(T3)硅处理对肥皂草叶片Gs [mol· (m2· s)-1]的影响 Table 6 Effects of Si on Gs [mol· (m2· s)-1] of S. officinalis leaves under severe drought stress |
T1条件下, 随天数的增加肥皂草叶片Gs下降不明显, 施硅增加了叶片Gs。T2和T3条件下, 随着干旱天数的增加, 肥皂草叶片Gs逐渐降低, 施硅进一步降低了Gs, 其中T3条件下0.3和0.4 g· kg-1硅处理下叶片Gs降低了50%。
2.1.3 叶片蒸腾速率 在T1条件下, 各处理下的叶片Tr随天数的增加变化不明显, 施硅增加了肥皂草叶片Tr, 且随着硅浓度的增加呈现先增高后降低的趋势。0.1 g硅处理较CK提高了1%~5%, 0.2 g· kg-1硅处理较CK提高了6%~12%, 0.3 g· kg-1硅处理较CK提高了11%~16%, 0.4 g· kg-1硅处理较CK提高了10%~17%。在每个时间点与CK相比, 0.3和0.4 g· kg-1硅处理均差异显著(P< 0.05), 0.1 g· kg-1硅处理则差异不显著(P> 0.05)(表7)。
| 表7 正常条件下(T1)硅处理对肥皂草叶片Tr [mmol· (m2· s)-1]的影响 Table 7 Effects of Si on Tr [mmol· (m2· s)-1] of S. officinalis leaves under normal condition |
在T2条件下, 随着干旱胁迫天数的增加, 各处理的叶片Tr呈下降趋势, 施硅降低了Tr, 且随着硅处理浓度的增加呈现先下降后上升趋势。0.1 g· kg-1硅处理较CK降低了3%~13%, 0.2 g· kg-1硅处理较CK降低了7%~13%, 0.3 g· kg-1硅处理较CK降低了15%~28%, 0.4 g· kg-1硅处理较CK降低了8%~24%。胁迫前10 d内, 0.3和0.4 g· kg-1硅处理显著低于CK(P< 0.05), 胁迫10 d后, 0.3 g· kg-1硅处理显著低于CK(P< 0.05)(表8)。
| 表8 中度干旱胁迫下(T2)硅处理对肥皂草叶片Tr [mmol· (m2· s)-1]的影响 Table 8 Effects of Si on Tr [mmol· (m2· s)-1] of S. officinalis leaves under mild drought stress |
T3条件下, 随着干旱胁迫天数的增加, 各处理的肥皂草叶片Tr呈下降趋势, 施硅降低了叶片Tr。0.1 g· kg-1硅处理较CK降低了3%~31%, 0.2 g· kg-1硅处理较CK降低了25%~54%, 0.3 g· kg-1硅处理
较CK降低了18%~54%, 0.4 g· kg-1硅处理较CK降低了18%~62%。在各个时间点, 0.3和0.4 g· kg-1硅处理显著低于CK(P< 0.05), 0.1 g· kg-1硅处理与CK相比差异不显著(P> 0.05)(表9)。
| 表9 重度干旱胁迫下(T3)硅处理对肥皂草叶片Tr [mmol· (m2· s)-1]的影响 Table 9 Effects of Si on Tr [mmol· (m2· s)-1] of S. officinalis leaves under severe drought stress |
在T1条件下, 施硅增加了肥皂草叶片Tr。在T2和T3条件下, 干旱胁迫使肥皂草叶片Tr下降, 施硅降低了叶片Tr, 如T3条件下的0.3和0.4 g· kg-1硅处理在第20天分别比CK降低了约54%和62%。
在T1条件下, 各个硅处理的肥皂草叶绿素含量随天数的增加缓慢降低, 施硅提高了叶绿素含量。其中0.1 g· kg-1硅处理比CK提高了1%~8%, 0.2 g· kg-1硅处理比CK提高了5%~11%, 0.3 g· kg-1硅处理比CK提高了9%~13%, 0.4 g· kg-1硅处理比CK提高了7%~13%。其中0.3、0.4 g· kg-1与CK相比差异显著(P< 0.05), 叶绿素含量最多比CK高0.32 mg· g-1。0.1和0.2 g· kg-1硅处理分别在前5 d和前15 d与CK相比差异显著(P< 0.05)(表10)。
在T2条件下, 随胁迫时间的增加, 肥皂草叶片叶绿素含量呈下降趋势, 施硅提高了叶绿素含量。0.1 g· kg-1硅处理比CK提高了3%~11%, 0.2 g· kg-1硅处理比CK提高了5%~36%, 0.3 g· kg-1硅处理比CK提高了8%~53%, 0.4 g· kg-1硅处理比CK提高了8%~53%。与CK相比0.3和0.4 g· kg-1硅处理在各个时间点差异均显著(P< 0.05), 在干旱胁迫第15-20天比CK高0.22~0.42 mg· g-1的叶绿素含量(表11)。
| 表10 正常条件下(T1)硅处理对肥皂草叶片叶绿素含量(mg· g-1)的影响 Table 10 Effects of Si on chlorophyll content(mg· g-1)of S. officinalis leaves under normal condition |
| 表11 中度干旱胁迫下(T2)硅处理对肥皂草叶片叶绿素含量(mg· g-1)的影响 Table 11 Effects of Si on chlorophyll content(mg· g-1)of S. officinalis leaves under mild drought stress |
T3条件下, 肥皂草叶片叶绿素含量进一步随着胁迫时间的增加而降低。施硅提高了叶绿素含量。胁迫
前15 d, 随着硅处理浓度的增加呈现先上升后下降趋势, 0.1 g· kg-1硅处理较CK提高了7%~19%, 0.2 g· kg-1硅处理较CK提高了20%~50%, 0.3 g· kg-1硅处理较CK提高了30%~75%, 0.4 g· kg-1硅处理较CK提高了30%~75%, 0.3、0.4 g· kg-1硅处理与CK相比在前15 d差异均显著(P< 0.05), 0.1、0.2 g· kg-1硅处理与CK相比分别在第1天与前10 d差异显著(P< 0.05)。胁迫第20天, 各处理与CK无显著差异(P> 0.05)(表12)。
肥皂草叶片叶绿素含量随着干旱胁迫时间的增加不断降低。3种水分梯度下, 施硅均增加了肥皂草叶片叶绿素含量。与CK相比0.3和0.4 g· kg-1硅处理效果显著, 其中在T3条件下最高提高了75%(表11)。
2.3.1 光响应曲线 在3种水分梯度下, 肥皂草叶片Pn均在一定光强范围内呈先升高后缓慢降低趋势(图1)。在T1条件下, Pn在PAR 0~200 μ mol· (m2· s)-1内呈直线增长, 400 μ mol· (m2· s)-1时增加缓慢, 1 200 μ mol· (m2· s)-1时, 随着PAR的增加呈缓慢降低趋势。施硅的植株Pn在PAR 600 μ mol· (m2· s)-1以后明显高于CK, 0.3和0.4 g· kg-1硅处理在PAR 1 200~1 600 μ mol· (m2· s)-1内增加值达3 μ mol· (m2· s)-1。
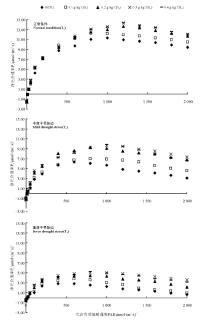 | 图1 不同干旱胁迫下施硅对肥皂草叶片净光合速率光响应曲线的影响Fig.1 Effects of application Si on photosynthetic curve of Pn of S. officinalis leaves under different drought stress |
T2条件降低了叶片Pn, Pn在PAR 0~200 μ mol· (m2· s)-1范围内呈直线增长, 400 μ mol· (m2· s)-1时增加缓慢, 800~1 000 μ mol· (m2· s)-1时开始缓慢下降。在PAR 400 μ mol· (m2· s)-1以后, 0.2、0.3和0.4 g· kg-1硅处理的Pn明显高于CK, 其中0.2 g· kg-1硅处理的Pn比CK高2.2~3.7 μ mol· (m2· s)-1, 0.3和0.4 g· kg-1硅处理的Pn均比CK高1.6~4.6 μ mol· (m2· s)-1。
T3条件极大降低了肥皂草Pn, Pn在PAR 0~100 μ mol· (m2· s)-1内呈直线增长, 200 μ mol· (m2· s)-1时增加缓慢, 600~800 μ mol· (m2· s)-1时呈缓慢下降趋势。在PAR 600 μ mol· (m2· s)-1以后, 0.2、0.3和0.4 g· kg-1硅处理的Pn明显高于CK, 其中0.2 g· kg-1硅处理的Pn比CK高1.5~2.0 μ mol· (m2· s)-1, 0.3 g硅处理的Pn比CK高2.0~3.0 μ mol· (m2· s)-1, 0.4 g· kg-1硅处理的Pn比CK高1.8~2.9 μ mol· (m2· s)-1。
2.3.2 光响应参数 T1条件下, 施硅升高了肥皂草叶片的Amax、Rd、LSP和AQY, 降低了LCP(表13)。在T2和T3下, 肥皂草叶片的Amax、Rd、LSP和AQY因胁迫程度的加剧而降低, LCP则随着胁迫程度的加剧而升高, 其中T2条件下, AQY随着硅肥浓度的增加而增高, Amax、Rd和LSP随着硅肥浓度的升高呈现先上升后下降的趋势, LCP则相反; T3条件下, Rd和AQY 随着硅肥浓度的增加而增大, Amax和LSP随着硅肥浓度的升高呈现先上升后下降的趋势, LCP随着硅肥浓度的升高呈现先下降后上升的趋势。0.2、0.3和0.4 g· kg-1硅处理与CK相比差异显著(P< 0.05)。
干旱使植物体内水分丧失, 叶片气孔的保卫细胞失水, 致使气孔关闭, 气孔导度、蒸腾速率降低, 干旱胁迫同时抑制叶绿素的合成, 这些也导致植物光合速率大幅度降低[1]。研究表明, 干旱导致3种委陵菜(Potentilla sericea、P. verticillaris、P. leucophylla)[15, 16]和华山新麦草(Psathyroetachys huashanica)[17]的Pn、Tr、Gs下降, 硅降低了干旱胁迫下水稻叶片的Gs和
而降低Tr, 提高了肥皂草叶片抗旱保水能力, 这与Agarie等[18]对水稻的研究结果一致, 其机理有待今后进一步研究。
干旱抑制了植物正常生理代谢, 降低植物光合速率, 从而使植物LCP升高, LSP降低。本研究表明, 干旱胁迫下, 肥皂草叶片LCP升高, LSP降低, 这与对黄栌(Cotinus coggygria)[21]和假俭草(Eremochloa ophiuroides)[22]的研究结果一致, 说明干旱对植株光合器官造成一定影响, 降低植物对光的敏感程度。施硅增加了干旱条件下肥皂草叶片LSP, 降低了干旱条件下肥皂草叶片LCP, 说明硅可以增大植株可利用的光辐射范围, 使植物在干旱条件下更好地利用光能。Rubisco活性和电子传递速率决定了植物叶片的Amax, Amax代表叶片最大光合能力[23], AQY与Rd的大小反映植物利用弱光能力的大小和植物呼吸作用的强弱, 与植物健康状态呈正相关。干旱降低了玉米叶片的Amax和AQY[24]; 降低了刺槐(Robinia pseudoacacia)、胡杨(Populus euphratica)与灰叶胡杨(Populus pruinosa)叶片的Amax、AQY、Rd[25, 26]。本研究表明, 干旱胁迫降低了肥皂草叶片的Amax、AQY、Rd, 并随着胁迫时间的延长继续下降, 施硅缓解了这些指标的显著下降, 这可能是因为硅提高了Rubisco活性和电子传递速率, 稳定了弱光下肥皂草的呼吸与光合作用, 从而减少干旱对植株的影响。
正常水分条件下施硅促进了紫花苜蓿(Medicago sativa)的生长, 提高产量[27, 28], 施硅还提高了水稻叶片的Pn、Gs、Tr和叶绿素含量[29], 使玉米、大豆(Glyxin max)叶片的Amax、Rd升高[30], 这与本研究结果一致。本研究还得出, 施硅使肥皂草叶片的LSP增加, LCP降低, AQY升高, 这可能是硅通过调节气孔导度和蒸腾速率来促进光合, 从而使肥皂草对光更加敏感, 更大范围地利用了光能, 并且提高了肥皂草对其他有益元素的吸收利用效率, 使植株健壮并保持较高新陈代谢, 从而加强了植物对光的利用能力, 具体机理有待进一步研究。
在3种不同水分控制条件下施硅均会影响肥皂草叶片光合特性。0.3和0.4 g SiO2· kg-1干土的硅处理在各种水分条件下与其他硅处理相比均显著调节了各项光合指标, 说明硅不仅能在正常条件下加强肥皂草光合呼吸作用, 从而更好地利用光能和调节自身新陈代谢, 还能够缓解干旱对肥皂草带来的伤害、增强抗旱性、保持光合作用的稳定、提高代谢活性。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|


