第一作者:张芯伪(1990-),男,山东梁山人,在读硕士生,研究方向为牧草病害及防治。E-mail:[email protected]
为确定在新疆地区紫花苜蓿( Medicago sativa)上发生的疑似丛枝病的病害种类,本研究提取了193个疑似紫花苜蓿丛枝病植株的总DNA,并以报道的植原体检测通用引物R16mF2/R16mR1和R16F2/R16R2为引物对其进行了巢式PCR扩增。其中23个样品获得了1.2 kb的特异片段,检出率为16.8%,确定该病害为紫花苜蓿丛枝病。构建的系统发育树结果表明,该植原体为16SrⅤ-B亚组成员,与榆树黄化植原体组(Elm Yellows Group,16SrⅤ)中卫矛白化( Euonymus Whitening)植原体的同源性高达99.1%。本研究首次采用分子生物技术确定了新疆紫花苜蓿丛枝病的病原是植原体,明确了其分类地位,该结果可为该病害的早期诊断、检测提供理论依据。
In order to determine the pathogen species of lucerne witches broom disease in Xinjiang, 193 lucerne samples with witches broom disease symptom were detected by nested-PCR with R16mF2/R16mR1 and R16F2/R16R2 universal primers for phytoplasma, and 23 samples had positive results with 1.2 kb specific fragment, which had detection rate of 16.8% and confirmed that the disease was witches broom. The phylogenetic tree showed that this phytoplasma strain was one member of 16SrⅤ-B subgroup which had 99.1% homology with euonymus whitening phytoplasma in Elm Yellows Group. To the best of authors knowledge, this was the first study to determine phytoplasma pathogen of lucerne witches broom disease in Xinjiang and identify taxonomic status using molecular biological techniques. These results provide theoretical basis for early diagnosis and detection of lucerne witches broom disease.
紫花苜蓿(Medicago sativa)为豆科苜蓿属多年生草本植物, 是世界分布最广的栽培牧草, 由于其品质优良, 适口性好, 被作为主要牧草广泛种植[1]。紫花苜蓿原产于小亚细亚、伊朗和外高加索一带, 在我国已有2 000多年的栽培历史, 因其营养丰富, 适口性好, 易于消化, 种植广泛, 故有“ 牧草之王” 之称, 在我国的主要产区为东北、华北、西北地区[2], 其营养价值远高于小麦(Triticum aestivum)和玉米(Zea mays), 在我国奶业的发展中发挥着不可或缺的作用[3]。
植原体(phytoplasma), 20世纪七八十年代被称为类菌原体(mycoplasma-like organism, MLO), 是一类无细胞壁的由生物膜包围的单细胞原核生物, 隶属于细菌界(Bacteria)厚壁菌门(Firmicutes)软膜菌纲(Mollicutes)[4], 常引起植株丛枝、黄化、花变叶, 使经济作物遭受很大的损失。至今, 已发现发生在植物上的1 000多种病害与植原体有关, 仅在我国报道的有100多种[5]。苜蓿的植原体病害在美国、加拿大、意大利及阿拉伯等国家均有发生[6, 7, 8, 9], 苜蓿丛枝病是由植原体引起的一类病害, 其感病植株矮小, 枝条丛生, 叶片均比正常叶片小, 叶片褪绿, 但植株仍能开花。在自然条件下, 苜蓿丛枝病的病原植原体是通过叶蝉进行传播的[10]。早在1991年, 陈耀等[11]借助电镜观察到来自新疆石河子的丛枝状苜蓿植株中有类菌原体(MLO)和类立克次氏体(RLO)的存在, 但未对其进行分类鉴定研究。
近年来, 随着退牧还草工程在四川、西藏、内蒙古、新疆等12个省(自治区)的实施[12], 新疆牧草产量有了明显的提高。但在新疆的苜蓿生产中发现, 新疆北部的阿勒泰、塔城、昌吉等地田间均有明显矮化、枝条细弱、叶变小等症状的疑似苜蓿丛枝病病株。调查发现, 1~2年草地的发病率低, 仅为1%~1.5%, 而4~5年草地的发病率则高达32.4%~81.7%, 病株鲜重仅为健株的42%~64%, 有些制种田因该病的普遍发生造成种子绝收。该病害的发生造成苜蓿种子大幅减产, 严重威胁着新疆苜蓿种子生产的安全; 造成打草田地面裸露多, 草地退化严重, 草产量降低。随着分子生物学技术大量用于病原生物的鉴定, 本研究对紫花苜蓿丛枝病的病原开展分子检测, 即对新疆紫花苜蓿产区的疑似丛枝病植株进行16S rDNA的PCR扩增、克隆和序列测定, 确定新疆紫花苜蓿丛枝病的病原, 从而正确认识该病害的病原种类及分类地位, 以期对该病害病原生理、抗病育种等研究提供理论依据。
病株样品于2014年8月和2015年4月采自新疆塔城、昌吉、阿克苏等地区, 主要症状表现为丛枝、小叶, 同时采集健康紫花苜蓿植株作为阴性对照, 样品均保存于-80 ℃冰箱中。枣疯病植株样为阳性对照, 由新疆农业大学植物病理重点实验室提供。
1.2.1 紫花苜蓿叶片总DNA的提取 分别称取0.1 g感病植株和健康植株的幼嫩叶片, 用植物基因组DNA提取试剂盒(Plant Genomic DNA Kit, TIANGEN)提取苜蓿叶片的总DNA, 并将DNA置于-20 ℃冰箱中保存, 备用。
1.2.2 16S rDNA的PCR扩增及电泳检测 参照Lee等[13, 14]设计的植原体16S rDNA通用引物对R16mF2/R16mR1和R16F2/R16R2序列提交深圳华大基因科技有限公司合成引物。引物序列如下:R16mF2:5’ -CATGCAAGTCGAACGGA-3’ , R16mR1:5’ -CTTAACCCCAATCATCGAC-3’ ; R16F2:5’ -ACGACTGCTGCTAAGACTGG-3’ , R16R2:5’ -TGACGGGCGGTGTGTACAAACCCCG-3’ 。
以提取的苜蓿植株总DNA为模板, 植原体16S rDNA通用引物R16mF2/R16mR1为引物进行直接PCR扩增。PCR反应体系均为25 μ L, 包括1 μ L DNA模板, 0.5 μ L Taq DNA聚合酶, 2.5 μ L 10× PCR Buffer(2.5 mmol· L-1 MgCl2), 1 μ L dNTP(10 mmol· L-1), 引物(10 μ mol· L-1)各1 μ L, 18 μ L dd H2O。反应条件:94 ℃预变性4 min; 94 ℃ 45 s, 55 ℃ 45 s, 72 ℃ 1 min, 35个循环; 72 ℃延伸10 min。
将直接PCR的产物用dd H2O稀释20倍作为模板, 以植原体16S rDNA通用引物R16F2/R16R2为引物进行巢式PCR扩增。反应体系同直接PCR。反应条件为94 ℃预变性4 min; 94 ℃ 45 s, 60 ℃ 30 s, 72 ℃ 1 min, 30个循环; 72 ℃延伸10 min。将PCR产物于1%琼脂糖凝胶中电泳检测, 使用凝胶成像系统拍摄并记录。
将巢式PCR扩增产物的特异目的条带切胶, 用快速凝胶回收纯化试剂盒(EasyPure Quick Gel Extraction Kit)回收、纯化, 与pEASY-T1(TRANS)在25 ℃下连接25 min, 再进行转化、涂板、筛选, 并将筛选到的含正确插入片段的质粒进行序列测定, 由上海生工生物工程股份有限公司完成。通过DNAMAN 8软件将测序获得序列与植原体16Sr各组中的各个代表性序列进行核酸同源性对比分析, 再使用MEGA 5.0中的邻接法(Neighbor-Joining)构建系统进化树。
春季苜蓿返青后即可表现症状, 病株生长矮小, 由 根颈基部长出大量分支, 枝条细弱, 丛生, 叶小、圆; 生长旺盛期病株高度仅有健株的1/4~1/2, 叶片大小不到正常叶片的1/3, 发病严重的不开花, 发病轻的仍能开花, 但开花结实少(图1)。
将疑似丛枝病样品总DNA用引物R16mF2/R16mR1和R16F2/R16R2进行巢式PCR扩增, 再电泳检测, 可观察到约1.2 kb的目的条带, 与Lee等[13, 14]的结果相同。对193个疑似紫花苜蓿丛枝病样品进行巢式PCR, 其中有23个样品可扩增出1.2 kb的特异性目的条带。193个样品中有137个样品采自北疆, 56个样品采自南疆。但检测出的23个样品均采自北疆, 故北疆紫花苜蓿丛枝病的检出率为16.8%, 而南疆样品并未检出。同时, 以枣疯病植株样为阳性对照, 也有1.2 kb的特异条带, 而健康苜蓿植株和双蒸水对照均未有特异条带(图2)。
将采自新疆的两个疑似丛枝病苜蓿植株经过总DNA的提取、巢式PCR、PCR产物回收纯化、克隆和序列测定, 获得的植原体16S rDNA分别为1 247和1 248 bp, 其中G+C含量分别为52.6%和52.5%。新疆紫花苜蓿丛枝病植原体的16S rDNA与植原体的16SrⅤ 组同源性最高, 最高可达99.1%, 而与其它组的同源性均低于97%(表1)。
| 表1 同16Sr各组代表性植原体16S rDNA基因片段的核苷酸同源性比较 Table 1 Comparison of nucleotide of 16S rDNA fragment from typical phytoplasma of 16Sr group |
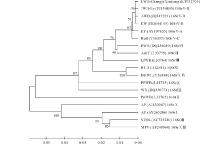
将新疆紫花苜蓿丛枝病植原体16S rDNA序列与GenBank中登录的植原体16Sr各组中的17个代表性序列比较, 并通过MEGA 5.0构建系统进化树(图3), 从而进一步对比分析。从构建的系统进化树观察可知, 新疆紫花苜蓿丛枝病植原体与榆树黄化(EY)、枣疯病(JWB)、苜蓿丛枝病(AWB)等16SrⅤ 组的各植原体株系在同一进化枝上, 确定其属于16SrⅤ 组, 并且与枣疯病(JWB-Ly)、苜蓿丛枝病(AWB)等同在16SrⅤ -B亚组。
本研究利用植原体16S rDNA通用引物, 对新疆紫花苜蓿丛枝病疑似植株进行巢式PCR检测, 可扩增出1.2 kb的特异条带, 测序序列均与植原体有同源性关系, 且与植原体的16SrⅤ 组同源性最高。证明了新疆紫花苜蓿丛枝病的病原为植原体, 与刘涛等[2]的研究结果相同。从而证明巢式PCR适用于新疆紫花苜蓿丛枝病植原体的检测, 对今后的检测提供了技术指导和理论论证。从构建的系统进化树观察可知, 检测序列属于16SrⅤ 组, 并且与枣疯病(JWB-Ly, GenBank登录号FJ154845)、苜蓿丛枝病(AWB, GenBank登录号JQ343221)等同源性关系最近, 确定其属于16SrⅤ -B亚组, 这符合16SrⅤ -B主要分布在亚洲的观点[4], 亦与黄槐丛枝病植原体[15](STWB, GenBank登录号AY283184)和枣疯病植原体[16](JWB-Aqsu Xinjiang, GenBank登录号JN571908)属于同一亚组。
由于植原体在植物中的含量较少, 且分布不均, 在试验过程中易受到试验条件的影响, 故使用电镜技术对植原体的检出率较低[17]。随着分子生物技术的快速发展, 给植原体的检测提供了技术支持。其中, 巢式PCR技术是植原体检测的主要技术, 一般适用于感病植株组织和介体昆虫组织中植原体含量很少的情况, 是在普通PCR的基础上进行的, 使植原体的检测灵敏度在普通PCR技术的基础上有一定的提高[18]。植原体病害是一种传染性很强的植物病害。通过对植原体的检测, 可及早发现感病植物体内植原体的存在, 对病害的防治和深入研究植原体病理特点具有重要的意义。
植物丛枝病是常见的植原体病害, 由不同组的植原体引起[19]。紫花苜蓿在我国广泛种植, 本研究发现新疆紫花苜蓿丛枝病和云南紫花苜蓿丛枝病的病原均为植原体, 但其分类地位却有所不同, 新疆紫花苜蓿丛枝病植原体属于16SrⅤ -B亚组, 而云南紫花苜蓿丛枝病植原体属于16SrⅠ -B亚组[2], 这说明在我国引起紫花苜蓿丛枝病的植原体有16SrⅤ -B和16SrⅠ -B两种类型。已知新疆紫花苜蓿丛枝病与榆树黄化、枣疯病、卫矛白化病等的植原体同属于16SrⅤ 组, 这些属于同一组的病害间有什么联系, 以及是否具有相互传染性还需进一步的研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|