第一作者:陈书珍(1964-),男,甘肃岷县人,高级农艺师,大专,主要从事作物栽培及作物保护方面的工作。E-mail:[email protected]
通过对甘肃省岷县马铃薯( Solanum tuberosum)窖藏干腐病的病原形态学鉴定,明确了其主要病原有7种,分别是木贼镰孢菌( Fusarium equiseti)、茄腐镰孢菌( F. solani)、三线镰孢菌( F. tricinctum)和尖孢镰孢菌( F. oxysporum)及3个待定种 Fusarium spp.,其中茄腐镰孢和木贼镰孢菌为主要病原,分离频率分别为41.67%和28.57%,且尖孢镰孢菌和木贼镰孢菌引起马铃薯干腐病属甘肃省首次报道。在窖藏期间使用32.5%苯醚甲环唑·嘧菌酯浓度为1.25~2.50 g·L-1喷施,防效为71.01%~81.84%,生物农药枯草芽孢杆菌B2浓度为100 g·L-1喷施,防效为79.71%,该研究结果为岷县马铃薯干腐病的诊断和防治提供了依据。
The pathogens causing potato dry rot disease during storage in the Minxian district of Gansu Province were identified as Fusarium equiseti, F. solani, F. tricinctum, F. oxysporum, and three other strains of Fusarium spp. Fusarium equiseti and F. solani were the most frequently occurring pathogenic fungi isolated from the diseased potatoes; frequencies of these isolates were 28.57% and 41.67%, respectively. Furthermore, this is the first reported case of potato dry rot disease caused by F. oxysporum or F. equiseti from Gansu Province. About 71.01% to 81.84% of the infestation was controlled by spraying 32.5% difenoconazole-azoxystrobin, while, spraying Bacillus subtilis B2 10 times during the storage period controlled 79.71% of the infestation. These provide the basis for control of the potato dry rot disease in the Minxian district of Gansu Province.
岷县地处青藏高原东麓与陇中黄土高原及陇南山地接壤区, 位于34° 07'34″-34° 45'00″ N, 103° 41'29″-104° 59'23″ E, 海拔2 040~3 700 m, 年均降水量600 mm左右, 无霜期约120 d, 年均气温5.7 ℃, 极端最高温31.8 ℃, 极端最低温-23.5 ℃, 属典型的高寒阴湿农业区。境内土层深厚、肥沃、质地疏松, 具中性或微酸性沙质黑壤土, 有机质含量高, 故当地特殊的地理位置、生态环境、土壤条件非常适宜于马铃薯产业的发展。近10年来岷县马铃薯年均种植面积达30万亩(约合2万hm2)以上[1]。马铃薯粮饲兼用, 其营养成分丰富且降解率较高, 可在肉羊养殖中作为较好的粗饲料广泛利用[2], 赵锋等[3]和谢婉等[4]也做了有关马铃薯饲用方面的研究。岷县农民将马铃薯块茎作为养猪的主要饲料, 为了周年供应饲料, 尽可能延长马铃薯贮藏期。但随着块茎贮藏期的延长, 干腐病等窖藏病害逐年加重, 造成大量薯块在出窑前腐烂, 严重影响块茎的质量和市场供应时限, 薯块腐烂也造成了农民的经济损失。常见的马铃薯储藏期真菌病害有马铃薯块茎干腐病(Fusarium spp.)、马铃薯晚疫病(Phytophthora infestans)、马铃薯早疫病(Alternaria solani)和马铃薯黑痣病(Rhizoctonia solani)等[5, 6, 7, 8]。在这些真菌病害中甘肃岷县以干腐病发生最重, 据报道[7]干腐病主要由镰孢菌引起。全球范围内谷物和动物饲料易受到镰刀菌毒素的污染[9], 且已明确镰孢菌所产毒素能够通过氧化途径影响动物小肠消化道功能并对其造成危害[10]。但是, 目前岷县引起马铃薯窖藏干腐病的主要病原种类有哪些?干腐病的有效防治措施等均未见系统报道。因此, 本研究从2013-2015年对岷县马铃薯窖藏干腐病进行鉴定及防治, 以期为岷县马铃薯窖藏干腐病的综合防控提供技术支撑。
1.1.1 马铃薯干腐病标样 马铃薯干腐病标样于2013年10月至2014年4月及2014年10月至2015年4月间采自甘肃省定西市岷县麻子川乡、寺沟乡、十里镇、西寨镇、梅川镇等乡镇农民的贮藏窖中。所有疑拟马铃薯干腐病样品首先简单清洗土壤后封装于自封塑料袋中, 带回实验室后立即进行症状描述和病原分离。
1.1.2 供试培养基 参考文献[11]配制水琼脂培养基(WA)、马铃薯葡萄糖琼脂培养基(PDA)和马铃薯蔗糖琼脂培养基(PSA)。
1.1.3 供试杀菌剂 供试药剂有30%丙环唑· 苯醚甲环唑 (可湿性粉剂, 先正达作物保护有限公司生产); 68%精甲霜· 锰锌(可湿性粉剂, 先正达作物保护有限公司生产); 32.5%苯醚甲环唑· 嘧菌酯(悬浮液, 先正达作物保护有限公司); 50%咪鲜胺锰盐(可湿性粉剂, 江苏洽益农化有限公司)、B2(甘肃农业大学提供的国家专利微生物菌剂, 专利号:ZL200910148250.9)、碧护(天然赤霉素、吲哚乙酸、芸苔素内酯等, 可湿性粉剂, 德国阿格福莱农林环境生物技术股份有限公司)和水杨酸(分析纯, 天津市化学试剂厂)。
1.2.1 症状观察 对采集的病薯进行症状观察和拍照。
1.2.2 病原的分离和致病性测定 采用组织分离法[11]对具典型症状的标样在马铃薯葡萄糖琼脂培养基(PDA)上进行病原菌的分离, 所有分离物均进行编号和保存, 根据菌落数计算分离频率。在健康马铃薯薯块表皮致伤, 并分别接种所有真菌分离物, 每分离物接5个薯块, 3次重复, 以接无菌水为对照, 100%相对湿度保湿48 h后置于25 ℃培养箱中观察发病情况, 形成典型症状后再次分离病原菌[11] , 根据柯赫氏法则确定病原菌。
1.2.3 病原菌的形态学鉴定 将病原镰孢菌接种于PDA培养基平板, 置于25 ℃恒温培养箱中培养, 连续观察菌落形状、颜色及气生菌丝等。镰孢菌的鉴定采用Booth[12]标准, 在PSA培养基上单孢分离后置于22 ℃恒温培养箱培养, 第5天测量菌落大小; 在pH 5~7和光/暗12 h /12 h交替培养条件下, PSA培养基平板上生长4 d后十字交法测量菌落直径, 第5天描述菌落形态, 第7天观察病原形态特征, 包括孢子和产孢梗形态, 并测量50个孢子的大小和拍照。参照文献[12-13], 根据病原培养性状、生长速率和形态特征等进行病原鉴定。
1.2.4 窖藏干腐病的药剂筛选 供试品种为陇薯3号一级种; 7种药剂每种药剂设3个浓度(表1), 在窖藏前施药, 每处理3次重复, 每重复处理40 kg马铃薯, 即将药剂配制成相应处理浓度, 均匀喷于马铃薯块茎表面, 以喷清水为对照, 晾干后分别装入塑料编织袋贮藏在岷县麻子川乡大草滩村农户窖藏窖中, 次年开窖调查发病率(%), 并按以下公式计算防治效果。
防治效果=[(空白对照发病率-药剂处理发病率)/空白对照发病率]× 100%。
| 表1 贮藏期马铃薯干腐病药剂筛选(2013年) Table 1 Screening of the effects of fungicides on potato dry rot during the storage period (2013) |
注:同一药剂不同浓度防效后标不同小字字母者表示差异显著(P< 0.05)。
Note: Different lowercase letters indicate significant difference among different concentrations at the 0.05 level.
发病薯块表面出现病斑且皮色变深、干缩、无光泽、凹陷, 病斑大小不等, 或愈合成片, 块茎上干腐病斑由外向内扩展, 病斑部位初呈褐色, 后期在块茎中间形成空腔, 其内形成粉白色、红色或黄色等颜色的绒毛状菌丝。
从马铃薯干腐样品中利用组织分离法共获得210株真菌分离物, 其中有镰孢霉属真菌分离物98株, 其分离频率为46.7%, 通过在马铃薯薯块上致伤接种, 其中有84株镰孢菌可以引起干腐病典型症状并可以再次分离到, 即该84株镰孢菌为甘肃省岷县马铃薯干腐病的病原菌。
通过病菌菌落形态特征和病原形态观察, 将84株致病菌鉴定为7个种, 其中茄镰孢菌株35株, 木贼镰孢菌24株, 分别占镰孢属真菌分离物的41.67%和28.57%, 为优势致病菌株, 其他5种共有25株, 占29.76%。镰孢霉属7个种鉴定如下:
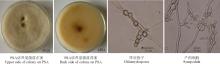
2.3.1 菌株1 在PSA上菌落白色至浅灰色、淡蓝色, 稍隆起, 较致密, 菌落背面土黄色, 且中间颜色深, 生长4 d后菌落半径2 cm; 在水琼脂培养基上菌落半径2 cm, 无色, 几乎看不见; 在PDA上菌落正面白色, 致密, 细绒状, 背面淡褐色; 菌丝无色, 小型分生孢子肾形或长椭圆形, 单孢, 大小平均为11.05 μ m× 3.06 μ m; 大型分生孢子马特型, 具3~5个隔膜, 基孢或有圆形足跟, 顶孢稍尖, 孢子稍弯曲, 大小平均为34.81 μ m× 5.53 μ m; 产孢梗单瓶梗, 较长, 长度平均为 56.45 μ m; 根据病原培养性状、生长速率和形态特征等, 参照文献[12-13], 鉴定菌株1为茄腐镰孢菌(Fusarium solani)(图1)。
2.3.2 菌株2 在PSA培养基上菌落白色, 稍隆起, 较致密, 基内菌丝呈淡紫色, 菌落背面呈米黄色; 在水琼脂培养基上菌落半径为2.4 cm; 在PDA培养基上菌落正面呈淡白色, 致密, 毡絮状, 略隆起, 菌落背面中部呈淡紫黑色, 边缘呈米白色; 菌丝无色, 有隔, 直径为1.2~2.9 μ m。在PSA培养基上产生小型分生孢子; 小型分生孢子短杆状或肾形, 两端圆, 少数稍弯曲, 单胞, 大小平均为9.88 μ m× 2.13 μ m, 产孢梗单瓶梗, 大小平均为8.9 μ m× 1.76 μ m; 未见大型分生孢子产生; 厚垣孢子近球形, 单生或对生, 直径为5~8 μ m。根据病原培养性状、生长速率和形态特征等, 参考文献[12-13], 鉴定菌株2为尖孢镰孢菌(Fusarium oxysporum)(图2)。
2.3.3 菌株3 在PSA培养基上菌落生长较稀疏, 初期呈白色, 后期呈肉色, 稍隆起, 菌落背面呈淡土黄色, 生长4 d后菌落直径6.6 cm; 在水琼脂培养基上4 d后直径4 cm, 无色, 几乎看不见; 在PDA培养基上菌落呈淡土黄色至土黄色, 稍隆起, 稍显絮绒状, 较密。菌丝直径为4.7~7.1 μ m, 呈淡黄褐色, 菌丝可结成较深颜色的菌索, 粗细不等; 大型分生孢子具2~4隔, 多3隔, 基孢有足跟, 一端明显变细, 整体呈弯月形、刀型或弯曲, 大小平均为16.8 μ m× 4.4 μ m; 未见小型分生孢子; 产孢梗呈单瓶梗, 刀状或瓶状, 常聚生呈扫帚状, 大小平均为15.1 μ m× 1.8 μ m; 根据病原培养性状、生长速率和形态特征等, 参考文献[12-13], 鉴定菌株3为木贼镰孢菌(Fusarium equiseti)(图3)。
2.3.4 菌株4 在PSA培养基上菌落正面呈白色, 隆起, 致密, 菌落背面呈淡褐色, 生长4 d后菌落半径为2.3 cm; 在水琼脂培养基上菌落呈无色, 生长4 d后菌落半径为2.2 cm; 在PDA培养基上菌落正面呈白色, 底部呈淡紫色, 隆起, 致密, 菌落背面呈暗红色。菌丝无色, 淡紫色, 直径1.8~4.7 μ m, 平均为2.4 μ m; 小型分生孢子呈柠檬形、梨形或瓜子形, 平均大小为12.3 μ m× 4.6 μ m; 大型分生孢子2~3个隔膜, 呈月牙形, 平均大小为42.6 μ m× 4.1 μ m; 产孢梗单瓶梗; 厚垣孢子串生或单生, 大小为6.1~9.8 μ m; 根据病原培养性状、生长速率和形态特征等, 参考文献[12-13], 鉴定菌株4为三线镰孢菌(Fusarium tricinctum)(图4)。
2.3.5 菌株5 在PSA培养基上菌落正面呈白色, 致密, 隆起, 菌落背面呈白色, 微现淡黄色, 生长4 d菌落半径为3.6 cm; 水琼脂培养基上菌落半径为3 cm, 无色; PDA培养基上菌落正面呈白色、隆起, 繁茂, 较致密, 背面淡黄色; 菌丝呈无色, 较粗, 直径平均为4.7 μ m; 在PSA培养基和PDA培养基上均未产孢。根据病原培养性状和生长速率等, 参考文献[12-13], 鉴定菌株5为镰孢属真菌(Fusarium sp.), 种待定(图5)。
2.3.6 菌株6 在PSA培养基上菌落正面呈白色, 致密, 隆起, 背面呈白色, 生长4 d半径为2.1 cm; 在水琼脂培养上4 d后半径为2 cm; 在PDA培养基上菌落正面呈白色, 隆起, 致密, 背面呈淡紫色; 菌丝有隔, 无色, 直径3.5~4.8 μ m, 其上产生无色、不规则膨大体; 小型孢子椭圆形, 单孢, 大小平均为6.9 μ m× 4.6 μ m; 大型孢子呈香蕉形或长椭圆形, 短杆状, 大小平均为15.9 μ m× 5.5 μ m; 产孢梗单瓶梗, 大小平均为9.4 μ m× 2.2 μ m; 厚垣孢子球形, 直径平均为7.3 μ m× 6.5 μ m。根据病原培养性状、生长速率和形态特征等, 参考文献[12-13], 鉴定菌株6为镰孢属真菌(Fusarium sp.), 种待定(图6)。
2.3.7 菌株7 在PSA培养基上菌落正面呈白色, 隆起, 致密, 菌落背面呈黄色, 呈淡褐色, 生长4 d半径2.2 cm; 在水琼脂培养基上4 d后半径为1.9 cm; 在PDA培养基上菌落正面与PSA培养基上相似, 菌落背面呈淡紫色; 菌丝无色; 小型孢子呈短杆状或纺锤形, 多为双孢, 大小平均为15.5 μ m× 5.3 μ m; 大型孢子2~3隔, 呈马特型, 顶部楔形, 基部楔形或有足跟, 壁较厚; 大小平均为12.5 μ m× 4.3 μ m; 产孢梗较短, 呈单瓶梗状, 大小平均为9.2 μ m× 1.8 μ m; 厚垣孢子单生, 球形, 直径为7~10 μ m。根据病原培养性状、生长速率和形态特征等, 参考文献[12-13], 鉴定菌株7为镰孢属真菌(Fusarium sp.), 种待定(图7)。
供试7种药剂对马铃薯腐烂均有一定的防治效果, 其中2.50、1.67和1.25 g· L-1的32.5%苯醚甲环唑· 嘧菌酯防效分别为81.84%、75.34%和71.01%, 特别是在2.5 g· L-1时防效显著高于其他浓度(P< 0.05); 生物农药枯草芽孢杆菌B2浓度为100、50和33.3 g· L-1时防效分别为79.71%、75.65%和71.14%, 100 g· L-1时显著高于33.3 g· L-1时的防效; 30%丙环唑· 苯醚甲环唑加碧护增效作用不显著(P> 0.05)。0.5 g· L-1的诱抗剂水杨酸基本没有防治作用, 但当浓度达到1.0和1.5 g· L-1时防效在60%以上, 显著高于0.5 g· L-1的防效, 有良好的诱导抗性。
通过对甘肃省岷县主要马铃薯贮藏库中的病薯调查及病原鉴定, 明确了岷县马铃薯窖藏干腐病主要由7种镰孢菌引起, 分别为茄腐镰孢菌、木贼镰孢菌、尖孢镰孢菌、三线镰孢菌和3个待定种。国外已报道的干腐病菌主要有尖孢镰孢、茄腐镰孢菌、茄腐镰孢菌蓝色变种、燕麦镰孢菌(F. avenaceum)、接骨木镰孢(F. sambucinum)、禾谷镰孢(F. graminearum)和黄色镰孢(F. culmorum)等[14, 15]。国内报道的干腐病菌主要有接骨木镰孢菌、茄腐镰孢菌、尖孢镰孢菌、燕麦镰孢菌、茄镰孢蓝色变种(Fusarium solani var. coeruleum)、半裸镰孢菌(F. semitectum)、木贼镰孢菌和拟丝孢镰孢菌(F. trichothecioides)等[16-19]。已报道的甘肃省干腐病菌有茄镰孢菌、接骨木镰孢菌和硫色镰孢菌(F. sulphureum)[7, 18]。李金花等[7, 19]于2011年报道甘肃省河西地区马铃薯干腐病的优势病原为接骨木镰孢菌和茄镰孢菌, 但接骨木镰孢菌和茄镰孢菌在甘肃省岷县样品中未分离到, 此可能与不同地区优势病原的差别有关。本研究中三线镰孢菌引起干腐病为国内首次报道, 尖孢镰孢菌和木贼镰孢菌引起干腐病为甘肃省首次报道。
为筛选绿色环保高效的马铃薯干腐病防治药剂, 本研究中选用了水杨酸和生物农药枯草芽孢杆菌(Bacillus subtilis)B2对入窖前马铃薯薯块进行了处理。枯草芽孢杆菌具有较强的抑菌防病作用, 如枯草芽孢杆菌对油菜菌核病菌有较好的抑制作用[20]; 梁宁和蒋继志[21]认为枯草芽孢杆菌在马铃薯病害防治中应用潜力巨大, 所筛选的拮抗菌株枯草芽抱杆菌B309对早疫病具有良好的防治效果。本研究中拮抗菌株枯草芽孢杆菌B2筛选自植物根围土壤, 刘晓妹等[22]对其抑菌能力、抑菌谱及抑菌机理等进行了测定, 其对干腐病有较好的防治效果, 另外, 0.1%水杨酸防效达66.12%。这些生物农药或诱抗剂, 对环境友好, 在薯块上无化学农药残留, 薯块食用安全, 表现出了良好的应用前景, 为马铃薯干腐病防治提供了新的思路。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|