第一作者:刘思妤(1992-),女,天津人,在读硕士生,研究方向为植物资源学。E-mail:2360204975@qq.com
以北细辛( Asarum heterotropoides)幼嫩叶柄诱导的愈伤组织为材料,初步建立悬浮培养体系,同时探讨接种量、光照、培养液量、转速、蔗糖浓度、激素配比等因素对细胞生物量的影响。结果表明,100 mL的1/2MS液体培养基中,2 g愈伤组织是最适接种量,蔗糖浓度为30 g·L-1,摇床转速150 r·min-1,0.6 mg·L-1 6-BA+0.3 mg·L-1 NAA,全天光照培养时细胞生长量最大。北细辛悬浮细胞生长曲线大致为“S”型,悬浮细胞的最佳收获周期为15 d。经悬浮培养后可快速获得细胞团及多种形态的单细胞,可为北细辛悬浮细胞的大规模生产提供依据,并进一步提升北细辛的应用价值。
Using the callus induced by young petioles of Asarum heterotropoides, a suspension culture system was established. Then the effects of the amount of inoculum, lighting time, amount of culture fluid, speed of rotation, and concentrations of sucrose and plant growth regulators on the cell suspension culture of A. heterotropoides were studied. The results showed that the optimal conditions for callus suspension culture were 2 g calli inoculated in 100 mL 1/2 MS liquid medium containing 0.6 mg·L-1 6-BA and 0.3 mg·L-1 NAA, a rotation speed of 150 r·min-1, 30 g·L-1 sucrose, and exposure to whole-day light. The growth curve of suspension cells of A. heterotropoides was S-type. The best harvest time of suspension cells was 15 d. Through the suspension culture, the cell masses and various forms of single cells could be obtained rapidly. These findings provide the basis for large-scale culture of A. heterotropoides suspension cells so as to enhance the application value of A. heterotropoides.
北细辛(Asarum heterotropoides)为马兜铃科细辛属的多年生草本植物, 主要分布于东北地区, 具有较高的药用价值[1]。挥发油是北细辛的主要有效成分, 其中甲基丁香酚、黄樟醚、细辛醚等多种成分均具有抗炎抗风湿、抑制各种致炎剂引起的肿胀反应及超强的清除自由基能力[2, 3], 其中黄樟醚是其有毒成分, 经过毒理试验基本了解了其在农业防治病虫害方面有一定作用, 但还未完全深入研究; 通常含量最多的甲基丁香酚还具有解热镇痛及明显的麻醉与中枢抑制作用[4]。但是, 由于北细辛野生资源骤减, 人工栽培又存在繁殖系数低及生长周期长等问题, 导致现有的北细辛原材料不能满足市场需求[5]。而植物细胞悬浮培养技术因具有易于控制环境、不受地域限制并且可以大规模培养的特点, 已成为解决植物种质资源短缺问题的有效途径[6, 7], 被广泛应用于天然活性成分的生产。目前已有苦瓜(Momordica charantia)、石榴(Punica granatum)、枇杷(Eriobotrya japonica)、长叶点地梅(Androsace longifolia)、狭叶柴胡(Bupleurum scorzonerifolium)等多种植物的悬浮培养研究[8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20], 但尚未见北细辛悬浮培养的研究报道。
基于北细辛组织培养前期的愈伤组织诱导、增殖研究结果[5], 本研究以北细辛幼嫩叶柄诱导出的松散型愈伤组织为初始材料, 探讨接种量、转速、植物生长调节剂等条件对北细辛悬浮培养的影响, 从而初步建立北细辛悬浮培养体系, 为后续北细辛细胞大规模培养产生有效活性成分奠定基础。
植物材料北细辛取自黑龙江省中医药大学药物园。由北细辛幼嫩叶柄诱导出愈伤组织, 继代培养时通过激素调控获得适于溶液培养的、松散的愈伤组织作为本研究的初始材料。
1.2.1 细胞悬浮培养体系的初步建立 取5 g愈伤组织, 用镊子夹碎后接种于装有100 mL液体培养基的250 mL锥形瓶中进行振荡培养, 培养基为1/2MS+0.2 mg· L-16-BA+0.9 mg· L-1NAA, 蔗糖浓度为30 g· L-1, pH 5.8。具体培养条件:培养温度(25± 2) ℃, 摇床转速为130 r· min-1, 全天光照24 h。每7 d继代一次, 继代前先静置30 min, 更换2/3的培养液, 经过2~3次继代可初步形成稳定的悬浮细胞系。
1.2.2 接种量对悬浮培养细胞生长的影响 分别取1、2、3、4、5 g愈伤组织接种到含有100 mL培养液的250 mL锥形瓶中进行培养, 培养条件同上, 重复3次。
1.2.3 光照时间对悬浮培养细胞生长的影响 取愈伤组织2 g(本研究确定的最适接种量)接种到含有100 mL培养液的250 mL锥形瓶中进行培养, 光照时间分别为全天光照、全天黑暗、12 h光照12 h黑暗, 其他培养条件同上, 重复3次。
1.2.4 培养液量对悬浮培养细胞生长的影响 取愈伤组织2 g接种到含有70、100、130、160、190 mL培养液的250 mL锥形瓶中进行培养, 全天光照(本研究筛选出的最适光照), 其他培养条件同上, 重复3次。
1.2.5 转速对悬浮培养细胞生长的影响 取愈伤组织2 g接种到含有100 mL(本研究筛选出的最适培养液量)培养液的250 mL锥形瓶中进行培养, 摇床转速为110、130、150、170、190 r· min-1, 其他培养条件同上, 重复3次。
1.2.6 蔗糖浓度对悬浮培养细胞生长的影响 取愈伤组织2 g接种到含有100 mL培养液的250 mL锥形瓶中进行振荡培养, 摇床转速为150 r· min-1(本研究筛选出的最适转速), 其他培养条件同上, 重复3次。
1.2.7 外源激素浓度对悬浮培养细胞生长的影响 取愈伤组织2 g接种到含有100 mL培养液的250 mL锥形瓶中进行培养, 除外源激素浓度外, 其他培养条件同上。6-BA和NAA协同使用, 进行二因素三水平的正交试验, 各重复3次。
1.2.8 悬浮细胞生长曲线的绘制 在优化的最适条件下, 每瓶接种2 g, 共培养25 d, 每隔5 d取样称重, 每个处理3次重复, 取平均值。以培养时间为横坐标, 鲜重为纵坐标, 绘制生长曲线。
1.2.9 悬浮细胞形态的观察 于培养的不同时期, 用移液枪吸取培养物置于载玻片上, 在显微镜下观察细胞形态及细胞分散度。
采用Excel 2003对数据进行统计与分析, 以GraphPad Prism软件完成数据制图。
2.1.1 接种量对北细辛悬浮培养的影响 起始接种密度对悬浮细胞的生长有一定影响, 过大或过小的接种量都不利于悬浮细胞的生长。当接种量为1 g时, 悬浮细胞活力较低, 细胞生长缓慢; 接种量为2 g时, 细胞增殖较快, 悬浮细胞生长率显著增加(P< 0.05); 当接种量大于2 g时, 细胞生长变缓, 悬浮细胞生长率显著下降(图1)。这可能是由于培养液中的营养成分不能满足大量细胞生长。因此, 北细辛悬浮培养时, 在100 mL的1/2MS液体培养基中, 愈伤组织细胞的最适接种量为2 g。
2.1.2 光照对北细辛悬浮培养的影响 在不同的光照培养下, 细胞生长率和细胞状态有所不同(图1)。当为全天光照时, 细胞生长较快, 细胞生长量最高, 且褐化较少, 培养液清澈明亮透明; 当为12 h光照时, 细胞生长率略低, 出现一定褐化现象, 培养液呈浅褐色; 当为全天黑暗时, 细胞生长率最低, 而且在培养2 h内培养液全部变为褐色。
2.1.3 培养液量对北细辛悬浮细胞生长的影响 悬浮培养时, 需适宜的溶氧量以保证悬浮细胞的生长。培养液100 mL时, 悬浮细胞生长率最高, 显著高于70、130、160和190 mL培养液(P< 0.05), 是北细辛悬浮培养的最适宜装液量(图1)。当培养液量为70 mL时, 装液量较少, 导致细胞不能及时获取营养而生长缓慢; 当培养液量大于100 mL并逐渐增加时, 装液量较大, 影响氧气的供应, 致使细胞不易增殖, 悬浮细胞生长率逐渐降低。
2.1.4 转速对北细辛悬浮培养的影响 摇床转速对悬浮细胞的增殖与生长有一定的影响(图1)。当摇床转速在110~150 r· min-1时, 随着转速的增加, 悬浮细胞生长量逐渐增加。摇床转速为150 r· min-1时, 悬浮细胞生长率最高, 细胞分散较好。但当摇床转速大于150 r· min-1时, 悬浮细胞生长率开始下降, 可能是由于摇床转速过大时, 剪切力过大, 导致细胞损伤或破裂。
2.1.5 蔗糖浓度对北细辛悬浮培养的影响 当蔗糖浓度为30 g· L-1时, 悬浮细胞生长率最高(图1)。当蔗糖浓度为25 g· L-1时, 细胞生长较慢, 培养液变浑浊; 而蔗糖浓度大于30 g· L-1并逐渐增加时, 悬浮细胞生长率逐渐降低, 不利于细胞的增殖生长, 这可能是由于较高的蔗糖浓度加大了培养基的渗透压, 不利于细胞吸收养分, 阻碍了细胞的生长。因此, 北细辛愈伤组织细胞悬浮培养时最适的蔗糖浓度为30 g· L-1。
2.1.6 不同外源激素浓度配比对北细辛悬浮培养的影响 不同激素配比对悬浮细胞的生长和增殖有一定的影响(图1)。通过正交试验的直观分析法, 计算得出k6-BA 0.2、k6-BA 0.4、k6-BA 0.6分别为0.510、0.585、
0.876, kNAA 0.3、kNAA 0.6、kNAA 0.9分别为0.695、0.648、0.629, 说明就6-BA而言, 0.6 mg· L-1为最适水平, 而NAA为0.3 mg· L-1。由极差分析得出, R6-BA为0.366, RNAA为0.066, 因此说明对悬浮细胞生长影响最大的是6-BA。同时, 图1表明 0.6 mg· L-1 6-BA与0.3 mg· L-1NAA协同使用时, 悬浮细胞生物量最大。
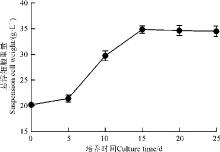
北细辛悬浮培养时以25 d为一个周期, 悬浮细胞生长曲线基本为“ S” 形(图2)。悬浮培养初期0-5 d为滞后期(图3A), 细胞生长较缓慢; 5-15 d进入对数生长期(图3B), 细胞快速生长并在15 d时达到最大; 15 d后进入了停滞期(图3C和D), 细胞生长不再有明显变化, 此时悬浮细胞开始出现褐化, 有的甚至死亡, 培养液逐渐变浑浊。因此, 悬浮细胞的最佳收获时期为15 d。
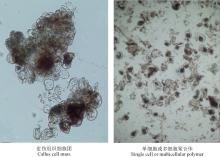
本研究建立的悬浮培养体系是由愈伤组织细胞团分裂成许多单细胞或多细胞聚合体(图4)。培养初期, 细胞呈现长条状, 有内含物(图5A), 生长较慢; 经过多次继代后, 可形成二、三或多细胞团(图5B和C), 并产生许多不同状态的单细胞:①较规则的圆球状, 内含物丰富(图5D); ②卵圆形, 内含物较少(图5E); ③不规则椭圆形, 内含物较丰富(图5F); ④草履虫状, 内含物较丰富(图5G); ⑤蝌蚪状, 内含物较少(图5H)。
药用植物细胞悬浮培养是产生有效活性成分的重要途径, 而悬浮培养体系的优化主要涉及培养条件的筛选。已有研究发现, 接种量、光照、培养液量、转速、蔗糖、外源激素等是影响悬浮细胞的生长和增殖的主要因素[9, 10]。较适宜的几种影响因素相互协调使用可建立起稳定的悬浮细胞, 如, 方文娟等[11]在草地早熟禾(Poa pratensis)中建立的悬浮细胞系; 单一来说, 在悬浮培养时, 悬浮细胞的生长具有群体效应, 初始接种量较低时, 悬浮细胞生长活力低, 阻碍了细胞的生长增殖, 细胞逐渐衰老死亡; 初始接种量较高时, 细胞迅速分裂生长, 从而大量消耗了培养基中的养分, 导致细胞过早处于饥饿状态, 过早衰老, 不利于悬浮细胞系的建立[12]。一些研究表明, 不同植物细胞悬浮培养体系中最适初始接种量不尽相同, 廖礼佳等[14]研究认为长春花(Catharanthus roseus)悬浮细胞培养时的最佳接种量为60 g· L-1, 而刘小英[9]进行枇杷悬浮培养时筛选出初始接种量为80 g· L-1, 本研究发现北细辛悬浮培养时100 mL培养液接入2 g愈伤组织细胞为最好, 即最适接种量为20 g· L-1。北细辛悬浮培养最适接种量低可能是由于北细辛悬浮细胞产生酚类物质, 过多积累将影响细胞的进一步生长和增殖。
光照在一定程度上影响着悬浮细胞的形态与结构分化[15]。王莉[16]研究认为悬浮培养时介入一定量的光照, 有利于生物量的提高, 但是全程介入光照反而不利于细胞的生长分裂。有所不同的是, 本研究发现在全天光照下北细辛悬浮细胞生长迅速, 很少出现褐化, 可能说明不同物种悬浮细胞生长规律有所不同, 具体原因尚需进一步探讨。
外源激素是植物细胞悬浮培养的关键因素之一, 其种类和浓度配比对于悬浮细胞的生长和增殖都有很大影响[17]。郭紫鹃[18]在进行白背三七(Gynura divaricata)悬浮培养时, 采用培养基B5+2.0 mg· L-16-BA+0.5 mg· L-1 NAA的培养基条件建立了良好的悬浮培养体系。而刘小英[9]在枇杷悬浮培养研究中发现使用单一植物生长调节物质可促进细胞的生长。基于前期北细辛叶柄愈伤组织诱导、增殖研究结果[5], 悬浮培养时仍同时选用6-BA和NAA, 研究发现0.6 mg· L-16-BA+0.3 mg· L-1 NAA的浓度组合更利于悬浮细胞的生长与增殖, 高于愈伤组织增殖培养时的最适浓度。建立的北细辛悬浮培养体系中可获得多种形态的单细胞, 与杜仲(Eucommia ulmoides)细胞培养相似[19]。目前, 尚未见与北细辛同属或同科植物的悬浮培养报道, 因此本研究结果不仅可为后续大规模生产北细辛天然活性成分奠定基础, 同时也为同属或同科近缘物种的细胞培养提供一定的借鉴。
由北细辛叶柄愈伤组织建立了悬浮培养体系, 筛选的最佳培养条件为100 mL的1/2MS液体培养基接入2 g愈伤组织细胞, 0.6 mg· L-16-BA+0.3 mg· L-1NAA, 摇床转速150 r· min-1, 30 g· L-1(3%)蔗糖, 全天光照培养。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| 21 |
|