第一作者:侯薪鑫(1994-),女,辽宁大连人,在读本科生,主要从事植物生物学研究。E-mail:[email protected]
为探明SO2湿沉降对桑树( Morus alba)幼苗生长和叶片光系统Ⅱ(PSⅡ)的影响,本研究利用Na2SO3和NaHSO3的混合液(浓度比为3∶1)模拟SO2湿沉降,连续处理两年龄的桑树幼苗28 d。结果表明,经浓度为50和100 mmol·L-1的混合液处理后,桑树幼苗的叶片出现明显的灼烧伤斑,叶片光合能力显著低于对照( P<0.05),株高、分枝数、叶片数也明显比对照低。而20 mmol·L-1模拟SO2湿沉降显著提高了桑树幼苗叶片光合能力( P<0.05),增加了株高、分枝数和叶片数( P<0.05),促进了桑树的生长。快速叶绿素荧光动力学参数分析表明,50和100 mmol·L-1混合液处理桑树幼苗,PSⅡ单位反应中心吸收的能量(ABS/RC)、反应中心消耗的能量(DIo/RC)和反应中心用于还原QA的能量(TRo/RC)与对照差异不显著( P>0.05),而反应中心用于电子传递的能量(ETo/RC)、照光2 ms时有活性反应中心的开放程度(Ψo)值和吸收光能用
In order to reveal effects of SO2 wet deposition on growth and photosystem Ⅱ(PSⅡ)of mulberry seedlings, Na2SO3 and NaHSO3 mixture (molar concentration ratio of 3∶1) were used to simulate SO2 wet deposition for foliage spraying for 28 days. The results showed that significant burns spot appear in leaves in treatments of 50 and 100 mmol·L-1 simulation SO2 wet deposition, meanwhile, photosynthetic ability was significantly lower than control( P<0.05), in addition, the plant height, branch number and leaf number were reduced significantly. However, the photosynthetic capacity of leaves were increased, and then, the plant height, branch number and leaf number were increased significantly, promoted the growth of mulberry. Rapid chlorophyll fluorescence kinetics parameter analysis showed that the absorbed light reaction center (ABS/RC), reaction center of dissipated energy (DIo/RC) and capture reaction center for energy reduction QA (TRo/RC) in treatments of 50 and 100 mmol·L-1 were no significant difference with CK. While, the reaction center capture of the energy for the electron transfer (ETo/RC), active reaction center of the light at 2 ms, open degree of active reaction center (Ψo) and absorb the light energy used for electron transfer quantum yield after
中国是以富硫能源为燃料的国家之一, 尤其是东北地区, 冬季寒冷, 主要以燃煤供暖, 同时随着水泥、冶金、煤气水电等工业的发展, 汽车数量增多, 大量的SO2输向大气, 导致空气中SO2含量增加[1]。迄今为止, 大气SO2沉降对植物影响的相关研究越来越深入, 目前认知中, SO2对植物生长代谢[2]、光合作用[3, 4]以及抗性[5]等方面的影响具有双重性。低剂量的SO2沉降被植物吸收后, 可被同化为含硫氨基酸, 参与叶绿体的合成, 有利于植物的生长[6]。高剂量的SO2沉降可引起雨水酸化, 进而导致土壤酸化, 间接影响植物生长发育[7]; 亦或是直接通过减少叶绿素含量, 阻碍光合作用等重要生命进程[8]。另有研究发现, 多种园林绿化植物对SO2吸收能力和抗性不同[9, 10, 11], 植物对SO2胁迫响应生理机制存在物种差异[12], 其中加杨(Populus canadensis)、旱柳(Salix matsudana)和花曲柳(Fraxinus rhynchophylla)对SO2的抗性强, 榆树(Ulmus pumila)、京桃(Prunus davidiana)和桑树(Morus alba)等对SO2的抗性中等, 而美青杨(Populus nigra var. italica× Populus cathayana)和丁香(Syringa oblata) 等对SO2的抗性弱[13]。当前, 我国在污染源层面上治理虽有成效, 但尚不能完全依赖于此, 为此, 城市栽种绿化植物是净化城市大气中硫化物污染有效途径之一[14]。深入探索比较植物对大气SO2的吸收和抗性阈值及其机制, 可为城市绿化及植树造林工程树种的选择提供参考依据。
随着国家“ 东桑西移、南桑北移” 工程的实施, 加之桑树生长迅速、抗逆性强, 可栽植范围推广, 使其在水土保持、荒地治理、退耕还林以及城市绿化等工程中, 被广泛开发应用[15]。研究表明, 桑树对盐[16]、干旱[17]、酸雨[18]等方面有很强的耐受性, 在大气SO2和铅复合污染区域可以正常生长[19]; 而在高浓度SO2环境中, 桑树叶片叶绿素含量减少, 抗氧化酶活性随着SO2浓度的升高先升后降[20]。叶绿素荧光与光合作用反应过程息息相关。叶绿素荧光技术被称为植物光合原初反应无损伤的探针[21], 可以探测植物叶片荧光变化, 尤其是可以测算出光系统Ⅱ (PSⅡ )生理状态的叶绿素快相荧光动力学曲线(OJIP), 已经成为探索逆境对植物光合作用影响机制的重要手段之一[22]。目前, 有关SO2沉降对桑树叶片PSⅡ 中电子传递和光能分配等方面研究尚不多见。为此, 本研究采用快相荧光动力学分析技术来着重分析探索桑树不同浓度SO2湿沉降, 对桑树幼苗生长及叶片PSⅡ 的影响, 探索桑树叶片光合生理过程对SO2胁迫响应的机制, 以期为桑树在大气SO2污染地区的种植开发提供参考依据和技术支撑。
试验所用桑树为两年龄“ 秋雨桑” 的实生苗, 试验于2015年5月在东北林业大学植物营养学实验室进行, 在试验之前为避免试验材料大小不同而造成的差异性, 将所有幼苗统一处理, 只保留主根和主茎各5 cm, 然后将幼苗移栽到适宜大小的培养钵中, 每钵定植3株。为确保试验土壤相对一致性, 将培养苗木所需的草碳土均匀混合后再与蛭石按1∶ 1混合装盆, 待幼苗培养30 d以后, 桑树植株长出6~7个叶片时, 挑取长势一致的桑树苗进行试验(6月初)。本研究以SO2进入细胞溶于水后主要以浓度比为3∶ 1的亚硫酸根和亚硫酸氢根离子状态存在为依据, 根据仪慧兰等[23]的方法, 配制浓度比为3∶ 1的Na2SO3和NaHSO3的混合液, 最终浓度分别为20、50、100 mmol· L-1, 以喷蒸馏水为对照, 每隔3 d, 早晚各喷施一次, 喷施时用喷雾器对叶片正反面均喷施, 直至叶片尖端流下细密液滴为止。处理28 d后, 桑叶表面出现病斑时, 测定桑树的生长指标、光合参数和叶绿素荧光参数, 每个处理设5次重复。
1.2.1 测定光合气体交换参数 选取生长状态较为一致的桑树苗, 利用Li-6400便携式光合作用测定系统(LiCOR inc, USA)对桑树苗主干的第3片或第4片完全展开叶进行测定[24]。该系统可记录输出的主要光合气体交换参数:叶片的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2的浓度(Ci)。
1.2.2 测定叶绿素快相荧光动力学曲线(OJIP) 桑树叶片经过0.5 h暗适应, 利用掌上叶绿素荧光仪(FluorPen FP 100 max, 捷克), 选择从上至下第3或4片完全展开叶进行OJIP的测定, 利用测得的从10 μ s到1 s的相对荧光值绘制OJIP曲线, 其中曲线上O、J、I和P点分别为当时间为0、2、30和1 000 ms时曲线上对应的点, K点表示0.3 ms时曲线上对应的点, 而L点表示0.15 ms时曲线上对应的点。对O-J曲线和O-K曲线分别进行标准化, 并进行作差处理。另外, 分析叶绿素荧光参数:PSⅡ 最大光化学效率(Fv/Fm)、光合性能指数(PIABS)、OJIP 曲线上J点的相对可变荧光强度(VJ)、QA被还原的最大速率(Mo)、照光2 ms时活性反应中心的开放程度(Ψ o)、光化学反应的最大量子产额(φ Po)、非光化学猝灭的最大量子产额(φ Do)、吸收光能用于
1.2.3 生长指标的检测 选取长势相对一致的桑树苗, 在光合气体交换参数和叶绿素荧光参数测定结束后, 测定桑树幼苗主干的高度为株高, 利用游标卡尺在主干接近地面处测其茎粗, 并统计单株叶片数及分枝数, 用直尺测量相对一致的成熟叶(从上向下数主干第4到6片展开叶)叶长和叶宽, 利用下面公式计算叶面积:叶面积=叶宽× 叶长× 0.634 5, 其中0.634 5为叶面积矫正系数。
运用Excel 2007和DPS 7.05对测得数据进行整理分析, 利用单因素方差分析法(One-way ANOVA)以及最小显著差异法(LSD)比较不同处理组间的差异显著性。
喷施模拟SO2湿沉降的Na2SO3和NaHSO3的混合液后, 桑树幼苗叶片最初边缘变褐、焦枯, 出现类似烧焦的痕迹(图1)。随着喷施时间的延续, 变褐焦枯的面积逐渐增大, 处理28 d后, 浓度为50和100 mmol· L-1模拟SO2湿沉降混合液处理的桑叶脱落, 且浓度越大脱落的越多, 而浓度为20 mmol· L-1混合液处理的桑树叶片表面仅出现零星伤斑, 叶色浓绿。
 | 图1 模拟不同浓度SO2湿沉降对桑树幼苗生长的影响Fig.1 Effects of simulating different concentration SO2 on mulberry seedlings growth |
浓度为20 mmol· L-1模拟SO2湿沉降混合液处理桑树幼苗的株高、茎粗、分枝数和叶片数分别较CK高出39.06%(P< 0.05)、15.76%(P> 0.05)、73.81%(P< 0.05)和69.09%(P< 0.05); 浓度为50 mmol· L-1处理组的株高和茎粗较CK分别略高6.01%(P> 0.05)和3.8%(P> 0.05), 分枝数和叶片数分别较对照低16.67%(P> 0.05)和4.20%(P> 0.05); 浓度为100 mmol· L-1处理组桑树株高、茎粗、分枝数和叶片数分别较CK低8.18%(P> 0.05)、0.60%(P> 0.01)、66.67%(P< 0.01)和25.55%(P< 0.01); 各浓度处理的桑树叶面积较CK均减小, 但其与CK间的差异不显著(P> 0.05)(表1)。
| 表1 模拟SO2湿沉降对桑树幼苗生长指标的影响 Table 1 Effects of simulating SO2 wet deposition on growth index of mulberry seedlings |
注: 同列不同小写字母表示不同处理组之间差异显著(P< 0.05), 不同大写字母表示差异极显著(P< 0.01)。表2同。
Note:Different lowercase and capital letters within the same column showed significant difference at 0.05 and 0.01 level, respectively; similarly for Table 2.
浓度为20 mmol· L-1模拟SO2湿沉降处理桑树叶片的净光合速率(Pn)、蒸腾速率(Tr)和气孔导度(Gs)较CK分别高出8.81%(P> 0.05)、11.41%(P> 0.05)和9.10%(P> 0.05)。而浓度为50 mmol· L-1和100 mmol· L-1的SO2湿沉降对桑树叶片光合作用有明显抑制, 这两种浓度处理的Pn值较CK分别降低了42.75%(P< 0.01)和68.85%(P< 0.01); 而Gs值较CK分别降低了36.36%(P< 0.05)和59.09%(P< 0.01); Tr值较CK分别降低了13.53%(P> 0.05)和36.60%(P< 0.05), 胞间CO2浓度(Ci)则较CK分别升高了6.15%(P> 0.05)和10.62%(P< 0.05), 气孔限制值(Ls)较CK分别降低了13.04%(P< 0.01)和17.39%(P< 0.01)。
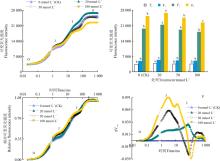
模拟SO2湿沉降的混合液改变了桑树OJIP曲线的形态(图2), 其中浓度为20 mmol· L-1处理的桑树叶片, Fo、FJ、FI 和FP都有所上升, 较CK分别升高了9.7%(P< 0.05)、9.4%(P< 0.05)、8.9%(P< 0.05)和5.4%(P< 0.05); 浓度为50和100 mmol· L-1处理组的Fo和FJ值较CK略有升高, 但差异不显著(P> 0.05), 两处理的FI和FP较CK略有降低, 其中50 mmol· L-1混合液处理而FI 和FP分别下降了2.3%(P> 0.05)和7.1%(P> 0.05), 100 mmol· L-1的混合液处理组FI和FP较CK分别下降了7.5%(P> 0.05)和12%(P< 0.05)。
将各处理桑树幼苗叶片的OJIP曲线按O-P标准化后可以发现, 20和50 mmol· L-1处理对桑树幼苗叶片标准化O-P曲线的影响较小, 各点相对可变荧光与CK之间均无显著差异(P> 0.05), 而100 mmol· L-1处理却使桑树幼苗叶片标准化O-P曲线上J点和I点的相对可变荧光明显增加(图2)。分别将SO2各浓度处理下桑树幼苗叶片标准化O-P曲线与CK做差值也可以看出, 高浓度SO2处理下桑树幼苗叶片与CK的相可荧光差值Δ Vt明显大于CK, 其中, 50 mmol· L-1处理中仅2 ms时即J点的Δ Vt差异较为明显, 而100 mmol· L-1除了J点外, 30 ms时即I点的Δ Vt差异同样比较明显。
| 表2 模拟SO2湿沉降对桑树叶片光合气体交换参数的影响 Table 2 Effects of simulating SO2 wet deposition on photosynthetic gas parameters of mulberry |
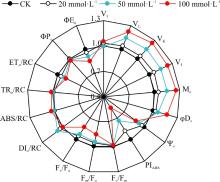
随着模拟SO2湿沉降浓度增加, 光合性能指数(PIABS)值逐渐下降, 浓度为20、50和100 mmol· L-1模拟SO2湿沉降混合液处理较CK分别降低了12.32%(P> 0.05)、26.10%(P< 0.05)和44.16%(P< 0.01)(图3)。模拟SO2湿沉降各处理桑树叶片PSⅡ 潜在最大光化学效率(Fv/Fm)值较CK略有降低(P> 0.05), 浓度为20和50 mmol· L-1模拟SO2湿沉降混合液处理桑树叶片PSⅡ 潜在活性(Fm/Fo)和PSⅡ 原初光能转化效率Fv/Fo较CK也略有降低(P> 0.05), 而浓度100 mmol· L-1模拟SO2湿沉降混合液处理桑树叶片Fm/Fo和Fv/Fo较CK分别降低了14.79%(P< 0.05)和17.09%(P< 0.05)。说明高浓度SO2湿沉降混合液对桑树叶片PSⅡ 活性具有抑制作用。
 | 图3 SO2湿沉降对桑树叶绿素荧光参数的影响Fig.3 Effects of simulating SO2 wet deposition on O-J and O-K curves of mulberry |
表示OJIP曲线J点(2 ms)关闭的反应中心的数量或QA的还原量(VJ)和表示QA被还原的相对速率的相对可变荧光的初始斜率(Mo), 可用于分析逆境胁迫对桑树叶片PSⅡ 电子传递链受体侧氧化还原状态的影响。本研究表明:浓度为20 mmol· L-1模拟SO2混合液处理对桑树叶片VJ和Mo的影响不大, 较CK分别高出5.97%(P> 0.05)和4.34%(P> 0.05); 而随着SO2湿沉降浓度增加, VJ与Mo增幅越明显, 浓度为50 mmol· L-1模拟SO2的混合液处理的Mo和VJ较CK分别升高了14.77%(P< 0.05)和23.86%(P< 0.01), 浓度为100 mmol· L-1模拟SO2混合液处理, Mo和VJ较CK分别高出14.38%(P< 0.05)和25.57%(P< 0.01)。
OJIP曲线的L点(0.15 ms)和K点(0.3 ms)的标准化的可变荧光(VL和VK), 可用于分析桑树叶片PSⅡ 电子传递链上供体侧放氧复合体(OEC)活性和类囊体膜的稳定性, 定量分析表明, 浓度为20 mmol· L-1处理的桑树叶片的VL和VK均与CK差异不大(图3)。50 mmol· L-1处理的桑树叶片的VL和VK较CK分别升高了14.17%(P< 0.05)和22.06%(P< 0.05), 而浓度为100 mmol· L-1处理的桑树叶片的VL与VK较CK分别显著下降了15.42%(P< 0.05)和25.21%(P< 0.05)。
模拟SO2湿沉降处理后的桑树叶片反应中心吸收的能量(ABS/RC)值、单位反应中心用于还原QA能量(TRo/RC)值和单位反应中心消耗的能量(DIo/RC)值均与CK差异不显著(P> 0.05)(图3)。而与CK相比, 浓度为20 mmol· L-1模拟SO2沉降混合液处理后, 桑树叶片单位反应中心捕获的用于电子传递的能量(ETo/RC)值下降了4.59%(P< 0.05); 而浓度为50和100 mmol· L-1混合液处理组的ETo/RC分别下降了8.44%(P< 0.05)和11.66%(P< 0.01)。而用于非光化学淬灭最大量子产额φ Do随着SO2湿沉降浓度的增加而增大, 随着SO2湿沉降浓度的增加所吸收光能用于QA以后电子传递链的量子产额(φ Eo)逐渐降低, 但用于表示PQ库容的VI值在模拟SO2湿沉降各浓度处理之间差异不大。
在本研究中, 模拟SO2湿沉降对桑树幼苗光合参数的影响具有剂量效应, ≤ 20 mmol· L-1模拟SO2湿沉降处理的桑树叶片Pn、Gs和Tr上升, 而Ci下降, Ls无变化, 说明低浓度SO2处理对桑树的光合性能具有促进作用。处理一段时间后, 促进效应直接体现在桑树幼苗生长指标即桑树幼苗株高、分枝数和叶片数明显高于CK。柯裕州[17]研究认为, 在抵御较低程度的胁迫时, 桑树的Pn会增加, 积累更多的同化物, 以抵御逆境对桑树的危害。除此外, 在本研究中, 低浓度SO2(≤ 20 mmol· L-1)湿沉降对桑树的生长具有促进效应的可能原因还包括两点:其一, 低浓度的SO2作为必需元素, 参与细胞的代谢和组成, 继而促进桑树生长; 其二, 桑树对大气中SO2具有一定的抵抗性。为此, 可以考虑在SO2低浓度污染区种植桑树, 净化空气。
通常情况下, 植物叶片Pn下降由气孔限制因素和非气孔限制因素导致, 当Pn下降伴随着Gs、Ci和Ls下降时, 意味着气孔因素导致Pn的下降; Pn和Gs下降、Ci值上升, Ls值不变或上升, 表明这是由非气孔因素造成Pn的下降[25]。在本研究中, 随着模拟SO2湿沉降浓度的升高(≥ 50 mmol· L-1), Pn下降、Ci上升、Ls下降, 说明Pn降低可能是由气孔因素和非气孔因素共同导致的, 即植物在受到SO2刺激时气孔开度和蒸腾速率下降, 同时CO2的同化受到抑制[12], 由此造成的过剩光能, 可能直接或间接地影响植物叶片PSⅡ 的结构和功能[26, 27]。相对具有表征性的光合气体交换参数, 具有内禀性的叶绿素荧光参数更能深入分析PSⅡ 对光能的吸收、传递、激发和分配等情况[28], 并且可快速准确地分析出逆境对植物光合作用中PSⅡ 的伤害位点[29, 30] 。在本研究中, 模拟SO2沉降处理改变了桑树叶片OJIP曲线的形态, 其中, 浓度为20 mmol· L-1模拟SO2沉降处理的各关键时间点的荧光强度增加, 对桑树叶片PSⅡ 的结构和功能具有促进效应。而高浓度50和100 mmol· L-1的模拟SO2沉降处理, OJIP曲线各关键时间点的荧光强度都明显下降, 说明PSⅡ 结构和功能可能受到抑制。在50 mmol· L-1混合液处理组, OJIP曲线出现K拐点, 而在100 mmol· L-1的混合液处理组, 除了K点外, L点的可变荧光强度均表现下降的趋势。K点的出现, 意味着放氧复合体(OEC)可能遭到破坏, L点的出现, 表示类囊体膜的稳定性下降, 即PSⅡ 供体侧电子传递受到抑制[31, 32]。在PSⅡ 受体侧
光合性能指数(PIABS)和PSⅡ 潜在最大光化学效率(Fv/Fm)通常用作评价植物对逆境抗性强弱的主要荧光参数。在本研究中Fv/Fm对SO2胁迫不敏感, 本课题组前期发现, Fv/Fm值也不能作为耐旱性的有效参数[16], 其原因在于Fv/Fm仅能反映反应中心的光能捕获情况, 而干旱和SO2胁迫并不影响PSⅡ 反应中心捕获光能。而PIABS可反映光合反应中心吸收光能的情况, 同时还可反映光合电子从PSⅡ 传递到PSⅠ 能力大小。说明高浓度的SO2抑制PSⅡ 的电子传递, 直接导致PSⅡ 向PSⅠ 电子传递能力降低, 有可能抑制PSⅠ 的生理功能, 而具体的影响程度需要进一步的探索。总之, 低浓度SO2(≤ 20 mmol· L-1)湿沉降对桑树的生长具有促进效应, 其可能的原因是, 低浓度的SO2作为必需元素, 参与细胞的代谢和组成, 继而促进桑树生长, 同时也证明桑树对SO2污染具有一定的抵抗性。
高浓度的SO2湿沉降(≥ 50 mmol· L-1)通过抑制PSⅡ 电子传递链受体侧放氧复合体(OEC)的活性及受体侧QA向QB电子传递, 导致桑树幼苗叶片光合性能下降, 进而抑制桑树幼苗的生长, 而低浓度的SO2湿沉降(≤ 20 mmol· L-1)可明显提高桑树叶片的光合性能, 促进桑树幼苗的生长。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|