第一作者:崔婷茹(1988-),女,河北沽源人,助理工程师,在读硕士生,主要从事农业气象研究。E-mail:[email protected]
本研究以狼尾草( Pennisetum alopecuroides)新品系LS-1为试验材料,研究在土壤干旱胁迫及复水条件下叶片相对含水量(RWC)、根冠比(R/S)、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、脯氨酸含量、可溶性糖含量的变化情况,探讨干旱胁迫对狼尾草生物学特性、叶片保护酶活性和渗透调节物质的影响,为优良抗旱品种选育提供理论依据。结果表明,随着土壤干旱胁迫时间的延长,狼尾草幼苗叶片相对含水量减小,根冠比增大,SOD和POD活性在土壤含水量降到5%时显著增强( P<0.05),脯氨酸和可溶性糖含量显著增加。复水后,狼尾草叶片各项生理指标均表现出不同程度的恢复。本研究表明,干旱胁迫可以促进狼尾草根系保护酶活性和渗透调节物质含量提高,对其应用于干旱地区园林绿化、生态修复具有重要价值。
To investigate the physiological mechanisms of drought adaptation and protective enzyme system of Pennisetum alopecuroides under drought stress, we took the new strain of P. alopecuroides, LS-1, as the test materials, and analysed the differences in the physiological characteristics, including relative water content in leaf, root/shoot ratios, superoxide dismutase (SOD) activities, peroxidase (POD) activities, free proline contents and soluble sugar contents under drought stress and rewatering conditions. The results showed that with increasing stress due to soil drought, the relative water content of leaf decreased, but the root/shoot ratios, SOD, and POD activities in 5% soil water content, free proline contents, and soluble sugar content all increased significantly ( P<0.05). After rewatering, the physiological characteristics of P. alopecuroides leaf recovered to different levels. Physiological mechanisms and protective enzyme system of P. alopecuroides offers the plant protection when under increased stress from drought. This is beneficial for the development of this species in drought areas.
狼尾草(Pennisetum alopecuroides)是禾本科狼尾草属多年生草本植物, 主要分布于全世界热带、亚热带地区, 少数种类可在温寒地区生长[1]。20世纪80年代初, 国外有研究表明狼尾草在水资源短缺地区是建造耐旱园林不可缺少的植物种类[2]。狼尾草株型优美, 形状似“ 喷泉” , 是观赏草家族中最具代表性的种类[3]; 另外, 狼尾草生长速度快, 生物量高, 营养丰富, 可作为牧草和能源草利用[4]。在澳大利亚、新西兰等多个海滨城市, 因其耐旱性极强和养护成本低, 狼尾草被用作建植城市绿地草坪[5]。国内对于狼尾草在园林绿化中研究和利用日渐增多, 主要集中在狼尾草属植物表型特性、园林及牧草上的应用[3, 4, 5], 引种狼尾草观赏价性评价[6, 7]、干旱胁迫下狼尾草种子萌发特性[8], 土壤干旱胁迫条件下的适应性[9]研究, 并开展了野生狼尾草种质资源调查和评价工作, 选育出狼尾草新品系LS-1[10], 但对于新品系干旱胁迫的生理特性鲜见报道。鉴于此, 本研究以狼尾草新品系LS-1为试验材料, 研究干旱胁迫及复水条件下狼尾草幼苗的抗旱生理特性, 以期为狼尾草优良品种育种提供理论依据。
供试材料为河北农业大学2015年选育的狼尾草新品系LS-1, 由河北省作物生长调控实验室提供。
试验于2015年6月6日-8月30日在河北农业大学草坪试验地防雨棚中进行, 6月6日, 选取之前温室育苗、长势良好、大小一致的狼尾草幼苗(有3个分蘖时)植入已装土的花盆中。试验所用塑料盆盆口直径为20 cm, 深度20 cm, 盆底直径14 cm, 每盆装土3.36 kg, 经筛分拌匀后施入一定量的复合肥。
试验采用盆栽控水方式, 狼尾草生长至每株5-6蘖时, 将60盆狼尾草随机分成对照组和试验组进行水分处理, 对照组为土壤含水量保持在20%左右; 试验组为持续干旱-复水, 即干旱阶段不浇水, 使土壤水分自然降低, 用称重法(每日09:00称重)监测土壤含水量, 当土壤含水量下降到5%时开始复水, 使土壤水分控制在对照水平, 每组处理各30盆, 每次取样选取植株长势一致3盆作为重复。
土壤绝对含水量平均值分别于胁迫1 d(8月22日)、3 d(8月24日)、6 d(8月26日)和8 d(8月28日)测定, 分别为20%、15%、10%和5%, 复水(20%)处理于第10天(8月30日)进行。将狼尾草幼苗整株取出, 放到水里浸泡, 待植株上的土体松软后再用自来水冲洗根系, 最后从水中取出完整植株, 再将狼尾草的根和冠从茎基部分开, 以备进一步测定使用。
叶片相对含水量:RWC=(Wf-Wd)/(Wt-Wd)× 100%.
式中:Wf为叶片鲜重, Wt为饱和鲜重, Wd为干重。测定叶片为每个分蘖最新完全展开叶片, 重复3次。取鲜叶, 用吸耳球吹掉表面灰尘, 称取鲜重, 再浸入水中24 h, 取出后吸干表面水分称饱和鲜重, 在80 ℃烘箱内烘干48 h至恒重, 称取干重[9]。
根冠比:将洗净的地上和地下部分别装入信封, 烘箱中105 ℃杀青30 min, 80 ℃烘干至恒重, 用电子天平将每部分称重。用地下部分干重比地上部分干重计算根冠比。
SOD活性采用氮蓝四唑光还原法, POD活性采用愈创木酚比色法, 脯氨酸采用酸性茚三酮显色法, 可溶性糖含量采用蒽酮法测定[11]。
采用Excel 2007录入数据, 并绘制柱型图; SPSS 19.0软件对所测数据进行方差分析, 用平均值和标准误表示测定结果, 在0.05显著水平下利用LSD法进行多重比较。
植物叶片相对含水量是反映植物水分状况最直接有效的指标, 与植物抗旱性密切相关[12]。狼尾草幼苗在持续干旱条件下, 其叶片的相对含水量持续下降(图1), 但复水后可迅速恢复其体内的含水量。当土壤含水量下降到5%时, 叶片相对含水量仅为59.18%, 显著低于20%、15%、10%土壤含水量(P< 0.05), 分别比20%、15%、10%土壤含水量降低36.85%、33.14%、17.77%。复水2 d后, 叶片相对含水量增加到92.16%, 与对照组无显著差异(P> 0.05), 但显著高于5%和10%的土壤含水量处理。
植物在生长过程中, 地上部分与地下部分的生长是密切相关的, 地上部分生长所需的水分和营养物质几乎全部由地下部分供给, 而根系所需的养分也需由地上部分同化作用合成来提供[13]。随着干旱胁迫程度的增加, 狼尾草幼苗根冠比呈增加趋势, 土壤含水量为5%时幼苗根冠比达到峰值, 为0.58, 显著高于其它处理(P< 0.05), 分别比20%、15%、10%以及复水处理高44.73%、20.07%、8.23%和18.66%; 复水后根冠比有所下降, 与对照及其余处理无显著差异(P> 0.05), 但显著低于土壤含水量为5%处理(图2)。
2.3.1 干旱胁迫及复水对SOD活性的影响 随干旱胁迫程度的提高, 狼尾草幼苗根系中SOD活性持续增强(图3)。在干旱胁迫初期, SOD活性增加缓慢, 但随着干旱胁迫的进一步加剧, 在土壤含水量为10%时, SOD酶活性为5 600.00 U· g-1FW, 显著高于土壤含水量为20%和15%处理和对照(P< 0.05); 土壤含水量下降到5%时, SOD酶活性最高, 为6 311.11 U· g-1FW, 比对照高3倍多(P< 0.05)。土壤复水2 d后, SOD活性较土壤含水量为5%时下降, 但无显著差异(P> 0.05), 显著高于对照、20%和15%处理。
 | 图3 干旱胁迫及复水对狼尾草SOD活性的影响Fig.3 Effect of drought stress and rewatering on SOD activities of Pennisetum alopecuroides |
2.3.2 干旱胁迫及复水对POD活性的影响 随着土壤干旱胁迫程度的提高, 狼尾草幼苗根系中过氧化物酶活性呈增加趋势(图4), 土壤含水量为5%时, POD活性最高, 为89.07 U· g-1FW, 显著高于其它干旱胁迫处理的POD活性及对照(P< 0.05)。复水后POD活性与对照及除5%处理外的其余处理无显著差异(P> 0.05)。
2.4.1 干旱胁迫及复水对脯氨酸含量的影响 脯氨酸作为一种渗透调节物质, 起着调节植物细胞渗透势的作用, 使植物维持一定的含水量和渗透压, 在植物抵抗水分胁迫时至关重要。随干旱胁迫程度的增加, 狼尾草幼苗根系中游离脯氨酸的含量增加(图5), 在土壤含水量为5%时增加到最大, 为1 370.24 μ g· g-1, 显著高于除10%处理外的其它处理(P< 0.05)。复水2 d后, 试验组的脯氨酸含量有所下降, 为1 062.70 μ g· g-1, 高出对照组22.96%(P> 0.05)。
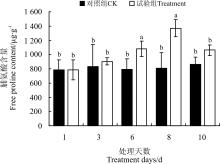 | 图5 干旱胁迫及复水对狼尾草脯氨酸含量的影响Fig.5 Effect of drought stress and rewatering on amino acid contents of Pennisetum alopecuroides |
2.4.2 干旱胁迫及复水对可溶性糖含量的影响 植物逆境胁迫诱导产生可溶性糖参与渗透调节[14]。狼尾草幼苗根系中可溶性糖含量随着土壤干旱胁迫程度的加剧而呈现快速增加的趋势, 土壤含水量降为5%时, 可溶性糖含量最高, 为64.66 mg· g-1, 显著高对照以及其它处理(P< 0.05)。复水2 d后, 可溶性糖含量迅速下降, 显著低于5%含水量处理, 与对照及其它处理无显著差异(P> 0.05)。
在正常的条件下, 植物体内保护酶 SOD、POD彼此协调, 而在逆境胁迫下, 植物体内活性氧产生和清除的平衡遭到破坏, 活性氧自由基增加, 当活性氧自由基浓度超过一定阈值时, 就会影响植物的正常生长[15]。植物需动员整个防御系统以抵抗过氧化伤害, 而防御系统中 SOD、POD 的活性高低就成为控制伤害的决定因素, 也能较好地反映植物对逆境的适应能力。本研究中, 干旱胁迫初期, 狼尾草根系中SOD和POD均增加, 说明在植物遭受干旱胁迫时, 保护酶会迅速增加以清除植物体内过多的自由基, 通过保护酶活性变化来保护植物内部组织, 减轻植株因植物土壤水分减少引起的损伤[16, 17]。当土壤持续干旱时, SOD和POD活性的增加在一定程度上减小了干旱对植株幼苗的损伤[18, 19]。干旱条件下, 狼尾草根系吸水不足, 地上部分难以正常生长从而导致叶片相对含水量下降; 而根系为了维持植株生存而生长迅速, 进而向更深的土层扎根以更充分的吸收水分, 从而导致根冠比增大。
水分胁迫下, 根系深扎吸水, 土壤和植物细胞间的水势发生变化, 植物细胞水势由低变高, 而水总是由高水势流向低水势, 因此当土壤含水量较低时甚至会导致细胞失水, 植物根系为了维持细胞膨压和渗透势, 细胞中的渗透调节物质脯氨酸和可溶性糖开始持续增加[20]。复水后, 狼尾草幼苗叶片和根系的各项生理指标均得到不同程度的恢复, 植株开始正常生长。狼尾草幼苗在干旱胁迫及复水条件下发生的这一系列生理变化可能是由于干旱胁迫及复水使得根系中产生化学信号, 该化学信号在植株体内传导, 进而引起地上部分和地下部分对土壤水分状况做出快速反应[21]。
随着土壤干旱胁迫时间的延长, 狼尾草幼苗叶片相对含水量减小, 根冠比增大, SOD和POD活性显著提高, 脯氨酸和可溶性糖含量增加。复水后, 狼尾草叶片和根系各项生理指标均表现不同程度的恢复。在狼尾草应用过程中, 适当控制土壤水分, 可以促进根系保护酶系统、渗透调节物质含量的升高, 对开发狼尾草应用于干旱地区园林绿化, 生态修复具有重要的价值。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|






