第一作者:邹竣竹(1993-),女,辽宁辽阳人,硕士,主要从事观赏植物发育生理与分子生物学研究。E-mail:[email protected]
为研究外源激素对野牛草( Buchloe dactyloides)种子破除休眠和幼苗生长生理的作用,本研究分别设置3个浓度的赤霉素(GA3)和生长素(IAA)对野牛草进行浸种处理,浸种后进行发芽试验,对浸种后种子的萌发及幼苗生长情况、非结构性碳水化合物和内源激素进行测定。结果表明,1)赤霉素浸种可以有效增强野牛草种子发芽力,提高发芽势、发芽率、发芽指数和种子活力指数,其中,2 000 mg·L-1的赤霉素处理效果最显著( P<0.05);适当浓度的生长素浸种可以有效增强野牛草种子的生活力。2)赤霉素处理有助于野牛草幼苗地上部的生长;生长素处理对野牛草幼苗地下部和根冠比有显著( P<0.05)的增强作用,其中较低浓度(250 mg·L-1)处理效果最明显。3)1 500 mg·L-1赤霉素与450 mg·L-1生长素浸种均可显著( P<0.05)提高野牛草幼苗可溶性糖与淀粉的积累。4)较高浓度的外源赤霉素和生长素浸种处理会使野牛草幼苗内源生长素、赤霉素、脱落酸(ABA)含量上升,其中,2 000 mg·L-1的赤霉素和450 mg·L-1的生长素浸种效果最佳。综上所述,打破野牛草种子休眠、促进地上部生长及其幼苗内源赤霉素含量的最佳试剂和浓度为2 000 mg·L-1的赤霉素,增加可溶性糖和淀粉在野牛草幼苗期积累的最佳试剂和浓度是1 500 mg·L-1的赤霉素;促进野牛草幼苗地下部生长的最佳试剂和浓度是250 mg·L-1的生长素,增加野牛草幼苗内源生长素和脱落酸含量的最佳试剂和浓度是450 mg·L-1的生长素。
In order to study the effects of exogenous hormones on breaking seed dormancy, and seedling growth of buffalo grass, seeds were soaked in three concentrations of gibberellic acid(GA3) and auxin(IAA) separately. After soaking, seed germination, seedling growth, non-structural carbohydrates, and endogenous hormone levels were measured. Our results showed: 1) Seed germination GA3 increased germination vigor and increased germination, germination rate, germination index and seed vigour index. Based on the treatment effects, gibberellin at 2 000 mg·L-1 had the most significant impact. Auxin also effectively enhanced the viability of the seeds, of which 450 mg·L-1 auxin yielded the best results. 2) Seedling growth GA3 treatment promoted the growth of aerial parts. IAA effectively increased buffalo grass seedling root length and root to bud ratio, at a low concentration of 250 mg·L-1, which yielded the best results. 3) Seedling non-structural carbohydrates-optimal GA3 concentration was 1 500 mg·L-1 while for IAA it was 450 mg·L-1, which could effectively increase the content of soluble sugars and starch in buffalo grass seedlings. 4) Seedling endogenous hormones ——IAA, GA3 and ABA, all increased with the treatment with exogenous gibberellin and auxin, of which GA3 at 2 000 mg·L-1 and IAA at 450 mg·L-1 provided best results. In summary, the best phytochemical to break dormancy in buffalo grass seeds and promote the growth of seedlings, buds and endogenous gibberellin is GA3 at a concentration of 2 000 mg·L-1. The best reagent to enhance soluble sugars and starch content in buffalo grass seedlings is also GA3 at a concentration of 1 500 mg·L-1. The best reagent to promote the growth of the buffalo grass seedlings and shoot growth is IAA, when applied at a concentration of 250 mg·L-1. Auxin at a concentration of 450 mg·L-1 was found to be the best hormone to increase endogenous IAA and ABA levels in buffalo grass.
野牛草(Buchloe dactyloides)是禾本科(Gramineae)画眉草亚科野牛草属植物, 原产于北美中部半干旱温带和亚热带地区, 是北美草原特有草种[1]。野牛草最初主要被用作牧草种植, 后来由于其许多优良的坪用特性, 如植株低矮, 叶片色泽优美, 质地柔软整齐, 适应性、抗逆性尤其是抗旱性极强, 需肥量少, 容易养护管理, 耐刈割等, 逐渐被用作草坪绿化植物[2]。但是, 由于野牛草合生颖苞对吸胀的种子形成的机械束缚和其种子的内部因素使种子休眠严重, 发芽率较低。相关研究表明, 同一花序内的不同颖果休眠程度不同, 导致发芽不整齐; 如不进行打破休眠处理, 即使在适宜的环境条件下, 也仅有少数种子萌发[3]。另外, 野牛草幼苗生长缓慢, 加之发芽不整齐, 播种后, 易导致杂草入侵, 建坪失败。因此, 野牛草种子破除休眠提高发芽整齐性和幼苗生长速度的研究具有重要意义。
目前, 外源植物激素在蔬菜和作物上的研究表明, 其有助于打破种子休眠, 促进幼苗生长。赤霉素(GA3)和生长素(IAA)是目前应用较普遍的两种主要的外源激素。其中, 使用赤霉素对休眠或静止种子进行处理, 有助于打破休眠, 提高种子中水解酶、乙醛酸循环酶等酶的活性, 促进新陈代谢, 为种子萌发提供碳水化合物和其它养分; 同时其可以促进植物细胞伸长, 茎秆伸长, 叶片扩展等[4]。生长素的主要生理功能是调节细胞伸长生长, 在适宜浓度范围内的生长素处理能够促进种子的萌发和根尖细胞的分裂; 促进茎伸长, 根加长加粗, 起到壮苗的作用, 提高幼苗的成活率, 较高浓度的生长素会抑制主根的生长, 促进侧根和不定根的伸长[5]。
本研究以野牛草 ‘ Spark’ 种子作为试验材料, 采用不同浓度的赤霉素、生长素溶液进行浸种处理, 研究外源激素对野牛草种子破除休眠及幼苗生长生理的影响, 以期了解不同浓度赤霉素和生长素在打破野牛草种子休眠, 提高发芽整齐性和发芽力, 促进幼苗生长生理方面的作用, 并找出最适宜浓度, 为合理使用植物激素促进种子萌发和幼苗生长提供理论依据, 对野牛草草坪建植有重要的参考价值。
野牛草‘ Spark’ 种子, 购自北京绿冠草业股份有限公司, 初始发芽率50%左右。
主要试剂:次氯酸钠溶液产自北京化工厂, 吲哚-3-乙酸(Indole-3-acetic acid, IAA)、赤霉素(2, 4a, 7-Trihydroxy-1-methyl-8-methylenegibb-3-ene-1, GA3)均购自Sigma公司。
试验分别设置IAA溶液浓度为250、350、450 mg· L-1, GA3溶液浓度为1 000、1 500、2 000 mg· L-1, 上述溶液对野牛草种子进行浸种处理。采用完全随机试验设计, 共6个处理, 每处理3个重复, 每重复50粒颖果, 以蒸馏水浸种处理为对照组CK。
去除野牛草种子颖苞, 选择成熟、饱满、健康的颖果为萌发材料。试验开始前, 将颖果用5%(V∶ V)次氯酸钠溶液浸种5 min进行消毒, 消毒后用蒸馏水漂洗3次。然后分别用20 mL浓度为250、350、450 mg· L-1的IAA溶液, 1 000、1 500、2 000 mg· L-1的GA3溶液和蒸馏水浸种14 h。将处理后的颖果分别均匀播入铺有双层滤纸的培养皿, 在人工气候箱内进行发芽。培养条件为光照10 h, 温度30 ℃; 黑暗14 h, 温度10 ℃。每天滴加适量蒸馏水, 使滤纸保持湿润。
每天记录各培养皿的发芽状况, 参照《牧草种子检验规程》[6]和《国际种子检验规程》[7]的鉴定标准将种子和幼苗归类, 第7天进行种子发芽势的测定, 14 d后从各培养皿中随机选取10株幼苗, 测定并记录根长和芽长, 并计算发芽率, 发芽指数, 活力指数, 根冠比; 14 d后从各培养皿随机称取幼苗0.5 g叶片进行各项生理指标的测定, 可溶性糖含量用蒽酮法测定[8], 还原糖用3.5-二硝基水杨酸比色法测定[8], 内源生长素、赤霉素和脱落酸用高效液相色谱与串联电喷雾离子质谱法测定[9]。发芽势(GE)、发芽率(GR)、发芽指数(Gi)、活力指数(Vi)和根冠比(R/S)计算方法如下:
GE=(第7天的正常发芽种子数/供试种子数)× 100%;
GR=(第14天的正常发芽种子数/供试种子数)× 100%;
Gi=∑ Gt/Dt;
Vi=Gi× Gx;
R/S=根长/苗长。
式中:Gt为某日的发芽数, Dt为与Gt对应的发芽天数, Gx为苗的平均长度。
采用Excel 2016完成所有数据的整理和作图, 采用SPSS 17.0统计分析软件对种子萌发、幼苗生长等指标进行单因素方差分析, 采用Duncan’ s法检验其差异显著性。
通过比较可知, 激素浸种对其发芽势和发芽率作用具有一致性(图1, 2)。GA3浸种, 其发芽势和发芽率均随GA3浓度的增加呈逐渐升高的趋势, 2 000 mg· L-1处理使发芽势从CK的37.63%增加到68.56%, 增加到最高, 较250和350 mg· L-1IAA和CK显著升高(P< 0.05), 发芽率较其它处理也是最高, 从CK的54.15%增加到73.28%, 但除显著高于CK外, 与其它处理间无显著差异(P> 0.05); IAA处理对其发芽势和发芽率作用均不显著, 且发芽势与发芽率随生长素浓度的增加呈先升后降再升的趋势, 发芽势和发芽率在450 mg· L-1的处理时达到最高, 分别从CK的37.63%增加到56.15%和从54.15%增加到62.15%。
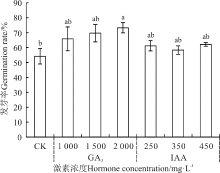 | 图2 赤霉素和生长素浸种对野牛草种子发芽率的影响Fig. 2 Effect of soaking seeds in gibberellin and auxin on B. dactyloides seed germination rate |
不同激素处理对野牛草种子的发芽指数影响不同(图3)。不同浓度GA3处理对其发芽指数均有显著的促进作用(P< 0.05); 随着处理浓度的增加, 发芽指数呈现上升趋势, 并在2 000 mg· L-1处理时达到最大, 从CK的21.06增加到48.52(P< 0.05)。不同浓度IAA处理对其发芽指数影响不同, 发芽指数随IAA浓度的增加呈现逐渐升高的趋势, 其中450 mg· L-1对其有显著的促进作用(P< 0.05), 发芽指数从CK的21.06增加到35.96, 其它浓度处理影响不显著。
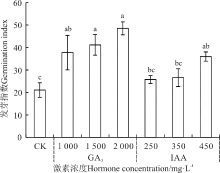 | 图3 赤霉素和生长素浸种对野牛草种子发芽指数的影响Fig. 3 Effect of soaking seeds in gibberellin and auxin on B. dactyloides seed germination index |
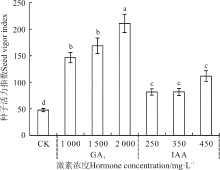 | 图4 赤霉素和生长素浸种对野牛草种子活力指数的影响Fig. 4 Effect of soaking seeds in gibberellin and auxin on B. dactyloides seed vigor index |
不同激素处理下, 野牛草种子活力指数的变化也不尽相同(图4)。GA3处理对种子活力指数有显著的提升作用(P< 0.05), 并且随着GA3浓度的增加, 种子活力指数呈现上升趋势, 并在2 000 mg· L-1处理达到最大, 使种子活力指数从CK的47.61增加到211.02; IAA处理对野牛草种子活力指数同样有显著提升作用(P< 0.05), 其中450 mg· L-1 IAA处理作用最明显, 使种子活力指数从CK的47.61增加到111.48; 同时, GA3处理对种子活力指数的提升作用均显著高于IAA处理。
综上发现, 2 000 mg· L-1GA3浸种可以打破种子休眠, 显著提高野牛草种子的发芽势和发芽率, 加快其种子萌发和成坪速度; GA3和IAA均可以显著增强野牛草种子的活力, 其中GA3作用更佳。
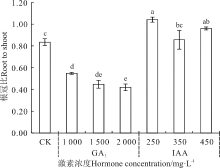
GA3处理对野牛草幼苗长有显著的增长作用(P< 0.05)(图5), 对根长作用不显著, 且其幼苗长随着GA3浓度的增加而呈逐渐增长的趋势, 在2 000 mg· L-1达到最大, 使幼苗长从CK的2.28 cm增长到4.83 cm, 而根长的变化趋势不明显; IAA处理, 250 mg· L-1显著增长了野牛草幼苗长(P< 0.05), 而随着生长素浓度的增加, 其幼苗长变化趋势不明显, 根长呈先增后减再增的趋势, 且生长素处理下的野牛草幼苗根长均显著增大(P< 0.05), 其中250 mg· L-1处理根长达到最大, 使其从CK的1.89 cm增长到3.35 cm。
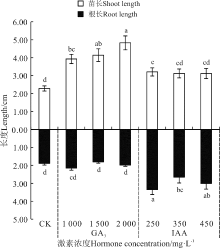 | 图5 赤霉素和生长素浸种对野牛草幼苗长和根长的影响Fig. 5 Effect of soaking seeds in gibberellin and auxin on B. dactyloides seedling length and root length |
分析发现, 激素对芽长和根长的作用并不相同, 因此通过分析各处理下的根冠比的变化可以进一步反映出根长和芽长的变化规律(图6)。GA3处理, 野牛草幼苗根冠比显著降低(P< 0.05), 且随着GA3浓度的增加, 根冠比逐渐下降, 并在2 000 mg· L-1达到最低; IAA处理中, 根冠比随着IAA浓度的增加呈先增后减再增的趋势, 并在250 mg· L-1达到最大, 且与 450 mg· L-1处理均使根冠比显著增大(P< 0.05), 350 mg· L-1处理虽然根冠比也升高, 但较CK无显著差异(P> 0.05)。
GA3浸种处理中, 只有1 500 mg· L-1处理使野牛草幼苗可溶性糖和淀粉含量显著增加(P< 0.05), 使其可溶性糖含量从CK的0.24%上升到1.05%(图7), 淀粉含量从CK的0.14%增加到0.38%(图8), 其余浓度作用均不显著(P> 0.05); IAA浸种处理, 只有450 mg· L-1处理使野牛草幼苗可溶性糖和淀粉含量显著增加, 使其可溶性糖含量从CK的0.24%上升到1.74%, 淀粉含量从CK的0.14%增加到0.34%, 其余浓度作用均不显著。
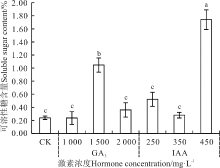 | 图7 赤霉素和生长素浸种对野牛草幼苗可溶性糖含量的影响Fig. 7 Effect of soaking seeds in gibberellin and auxin on B. dactyloides seedling soluble sugar content |
外源GA3处理下, 野牛草幼苗内源IAA含量随着赤霉素GA3浓度的增加呈现逐渐增长的趋势, 在1 500和2 000 mg· L-1处理下显著提升(P< 0.05), 并在2 000 mg· L-1处理下达到峰值, 较CK增加了269.44%(图9)。外源IAA处理下, 内源IAA含量随着外源IAA浓度的增加呈先增加后小幅降低再显著增加的趋势, 其中, 250和350 mg· L-1处理与CK间无显著差异(P> 0.05), 450 mg· L-1处理下显著增加(P< 0.05), 较CK增加了437.13%。
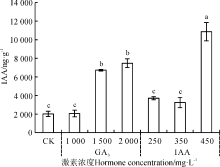 | 图9 赤霉素和生长素浸种对野牛草幼苗IAA含量的影响Fig. 9 Effect of soaking seeds in gibberellin and auxin on B. dactyloides seedling IAA content |
外源GA3浸种对野牛草幼苗内源GA3的作用随着外源GA3浓度的增加呈先减后增的趋势, 并在2 000 mg· L-1处理下显著上升到最高(P< 0.05), 较CK增加了338.77%; IAA浸种处理下, 250和350 mg· L-1对野牛草幼苗内源GA3作用同样不显著(P> 0.05), 而450 mg· L-1处理作用显著, 使其较CK增加了244.93%(图10)。
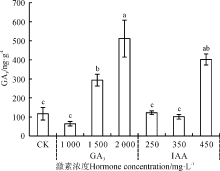 | 图10 赤霉素和生长素浸种对野牛草幼苗GA3含量的影响Fig. 10 Effect of soaking seeds in gibberellin and auxin on B. dactyloides seedling GA3 content |
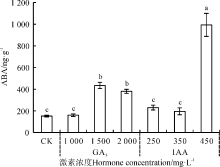
外源GA3和IAA浸种对野牛草幼苗内源ABA的作用与对其内源IAA和GA3作用相似, 其中, 1 500、2 000 mg· L-1GA3和450 mg· L-1IAA处理使其内源ABA含量显著上升(P< 0.05), 450 mg· L-1IAA处理下最高, 使其较CK上升了553.11%, 1 500 mg· L-1GA3次之, 使其上升了185.46%, 其余浓度的激素浸种对野牛草幼苗内源ABA作用均不显著(P> 0.05)(图11)。
当植物胚胎发育完成后, 种子发育停滞并进入休眠状态, 坚硬的种皮阻碍水分吸收、气体交换以及代谢化合物(如ABA和各种次生代谢物)流失等, 成为抑制种子萌发的物理屏障。当外界环境适宜时, 种子充分吸水后, 胚根伸长并穿透种皮, 完成种子萌发[10]。依据植物激素调节休眠理论可知[11], 种子的休眠和萌发主要取决于种子各激素的存在状况和相对含量。本研究通过赤霉素和生长素对野牛草种子萌发和幼苗生长影响的研究, 得出赤霉素和生长素能够打破野牛草种子休眠和促进幼苗生长。
赤霉素可以促进发芽, 破除种子休眠, 这是因为赤霉素可以诱导以α -淀粉酶为主的多种水解酶产生, 这些水解酶动员胚乳储存物, 为种子萌发提供碳水化合物和其它养分[10]。生长素的主要生理功能是调节细胞伸长和分裂。本研究用赤霉素和生长素浸种后的种子进行发芽试验, 结果发现赤霉素浸种可以有效增强野牛草种子发芽力, 提高发芽势、发芽率、发芽指数和种子活力指数, 并且随着赤霉素浓度的增加, 其作用效果呈增强趋势, 2 000 mg· L-1的赤霉素处理效果最显著。生长素对野牛草种子发芽力有一定提高作用, 但与赤霉素相比, 效果较弱; 较高浓度(450 mg· L-1)的生长素浸种可以有效增强野牛草种子的生活力。本研究所有浓度的赤霉素均可以显著提高野牛草种子的发芽指数和种子活力指数, 对破除其休眠、提高发芽整齐性有明显的作用, 该结果与纳罗克非洲狗尾草(Setaria sphacelata)[12]、黑麦(Secale cereale)[13]、樟子松(Pinus sylvestris)[14]等种子萌发的研究结果相似, 但促进不同植物种子萌发所需的赤霉素浓度不同; 本研究所有浓度的生长素对种子发芽率、发芽势作用均不显著; 450 g· L-1的生长素可以显著提高野牛草种子的发芽指数和种子活力指数, 说明生长素对提高野牛草种子的生活力有一定作用。该结果与纳罗克非洲狗尾草种子[12]、云南松(Pinus yunnanensis)种子[15]、桑树(Morus alba)种子[16]、小麦(Triticum aestivum)种子[17]、四椎木(Tetracarpidium conophorun)种子[18]等萌发的研究结果相似, 但生长素作用的效果及浓度对不同植物种子各不相同。
赤霉素不仅能促进种子萌发, 也对植物营养生长时期的各器官形成和大小控制发挥着重要作用, 包括下胚轴、叶片伸展、株高以及根系发育等。赤霉素既能促进细胞伸长也能促进细胞分裂, 进而调控植物株高和器官大小[10], 不同植物对赤霉素的反应差异较大。同时, 在幼苗萌发过程中, 生长素类物质可以通过调节内源活性物质的水平和代谢, 对植物的生长发育和生理生化有着重要影响, 参与了植物生长和发育的诸多过程, 如根和茎的生长等。
本研究结果表明, 赤霉素浸种处理对野牛草幼苗地上部的生长有显著的增强作用, 但对其根冠比有显著降低作用, 并且其作用效果随赤霉素浓度增加而增强; 2 000 mg· L-1的赤霉素对野牛草幼苗芽长的促进作用和根冠比的降低作用最显著; 说明赤霉素浸种可以促进野牛草幼苗地上部的生长, 从而促进其成坪。该结果与在大叶白蜡(Fraxinus chinensis)[19]、萝卜(Raphanus sativus)[20]、梧桐(Firmiana platanifolia)[21]等研究上的结果相似; 生长素浸种处理对野牛草幼苗地下部和根冠比有显著的增强作用, 较低浓度(250 mg· L-1)处理效果最明显。说明生长素浸种有利于提高野牛草幼苗根系发育, 从而起到壮苗的作用。该结果与箭叶秋葵(Abelmoschus sagittifolius)[22]、丁香(Ludwigia hyssopifolia)、绿豆(Vigna radiata)[23]等幼苗生长的研究结果相似, 而生长素对幼苗生长的诱导通常具有两重性, 既能促进生长, 也能抑制生长, 这主要取决于施用的浓度和植物、器官的类型等[24]。
非结构性碳水化合物是对植物碳分配与碳消耗差值的量化, 能够反映植物利用光合产物的水平, 以及植物对其生存环境的响应[25]。非结构性碳水化合物主要包括可溶性糖(如葡萄糖、蔗糖、果糖等)和淀粉[26]。幼苗中可溶性糖既来源于种子胚乳中淀粉水解的产物, 也是其光合作用的直接产物, 用于满足植物当前生命活动需要, 淀粉是植物长期的贮存形式, 主要供应植物将来的需求[27]。本研究结果表明, 适当浓度的赤霉素(1 500 mg· L-1)与生长素(450 mg· L-1)浸种均可显著提高野牛草幼苗可溶性糖与淀粉的含量, 增加了幼苗期非结构性碳水化合物的积累, 增强了其幼苗的碳素代谢能力, 对幼苗的生长更有利。与牡丹(Paeonia suffruticosa)[28]、小麦[29]和水稻[30]等研究结果有相似之处。
内源激素作为植物新陈代谢的重要调控者之一, 参与了一系列生理生化过程[31]。内源生长素可以调控植物根和叶片中营养元素的运输, 可以影响植物主根、侧根和根毛的形成, 促进叶原基的发生。内源赤霉素在植物营养生长时期的各器官形成和大小控制发挥着重要的作用, 包括叶片伸展、株高以及根系发育等, 生长素可以通过调节赤霉素的合成和代谢, 与赤霉素共同调控主根延伸。内源脱落酸对植物生长发育有很重要的作用, 与生长素和赤霉素在多个过程中存在相互作用。植物通过生长素和脱落酸的平衡来控制侧根的发育, 种子萌发和幼苗生长时期, 脱落酸与赤霉素具有拮抗作用[10]。
本研究表明, 较高浓度的外源赤霉素(1 500、2 000 mg· L-1)和生长素(450 mg· L-1)浸种处理会使野牛草幼苗内源生长素、赤霉素和脱落酸含量上升, 其中, 2 000 g· L-1的赤霉素和450 mg· L-1的生长素浸种效果对其促进作用最佳, 从而增强了野牛草幼苗生长过程中各类生理代谢活动的活性, 这也从植物激素调节理论解释了本研究中赤霉素和生长素浸种野牛草幼苗株高、根长、根冠比与非结构性碳水化合物等各方面的促进作用。
综上所述, 赤霉素和生长素浸种对野牛草种子破除休眠、提高发芽整齐性和促进幼苗生长生理分别有不同程度的作用, 本研究结果表明, 打破野牛草种子休眠、促进地上部生长以及其幼苗内源GA3含量的最佳试剂和浓度是赤霉素2 000 mg· L-1, 增加可溶性糖和淀粉在野牛草幼苗期积累的最佳试剂和浓度是IAA 450 mg· L-1和赤霉素1 500 mg· L-1; 促进野牛草幼苗地下部生长的最佳试剂和浓度是IAA 250 mg· L-1, 增加野牛草幼苗内源IAA和ABA含量的最佳试剂和浓度是450 mg· L-1的生长素。本研究只对单一激素影响野牛草种子生理生化指标做了研究, 多种激素混用或分阶段处理在野牛草种子打破休眠和成坪中的作用, 值得进一步研究和探讨。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|