第一作者:曹师(1988-),男,甘肃兰州人,在读博士生,研究方向为牧草病理学。E-mail:[email protected]
红豆草壳二孢叶斑黑茎病( Ascochyta onobrychidis)是红豆草( Onobrychis viciaefolia)最重要的病害之一,在分离此病菌的同时得到一种对此病菌具有较强抑制作用的微生物,为评价此拮抗菌的开发利用前景,本研究采用形态学、分子生物学和生物化学方法鉴定了其分类地位,并测定了其对红豆草壳二孢的抑菌效果。通过构建系统发育树并结合其形态特征和生理生化特性,将该拮抗菌鉴定为微白黄链霉菌( Streptomyces albidoflavu),在高氏一号培养基上菌落为黄白色,可产生黄白色水溶性色素,孢子丝钩状,顶端螺旋形;在平板对峙试验中该菌的菌落对红豆草壳二孢菌落的相对抑制率达74.33%,同时该菌发酵液对红豆草壳二孢菌丝生长和孢子萌发的抑制率分别为80.95%和93.87%。该菌具有生物防治红豆草壳二孢的开发和利用价值。
Ascochyta onobrychis is the causal pathogenic microorganism of sainfoin leaf spot and black stem, which is a serious disease. A strain of microorganism that has strong antagonistic activity against A. onobrychis was obtained when the pathogen was isolated. To evaluate the exploitation and foreground of the antagonistic microorganism, the present study identified the taxonomic position of the strain by morphological, molecular, and biochemical methods, as well as determined the inhibitory effect of the strain against A. onobrychis. Based on its morphological characteristics, both physiological and biochemical, together with 16S rDNA sequence analysis, the strain was identified as Streptomyces albidoflavus. The colonies ware yellowish white in color on Gause’s agar and produced yellowish white water-soluble pigments and a mycelium hook-like top spiral. The relative inhibition rate to the pathogen was 74.33% that was measured with the dural culture method. The actinomycetes sterile fermentation broth had a strong effect on mycelial growth and spore germination, with inhibitory rates of 80.95% and 93.87%, respectively. The results showed that the actinomycetes had potential value in the biological control of A. onobrychis.
红豆草(Onobrychis viciaefolia)是豆科(Leguminosae)红豆草属多年生牧草, 是一种高产优质的豆科牧草, 饲草和种子都含有丰富的营养物质[1]。有“ 牧草皇后” 之称[2]的红豆草其饲用价值可与“ 牧草之王” 紫花苜蓿(Medicago sativa)相媲美。然而病害是红豆草生长和生产的重要限制因素, 植株染病后可严重影响种子质量和植株的生物量[3-4]。在我国由红豆草壳二孢(Ascochyta onobrychidis)引起的叶斑与黑茎病是红豆草生最为常见的一种病害, 主要分布在内蒙古、甘肃和新疆等地[5]; 同时该病在国外也分布广泛, 主要分布在欧洲, 不同的是在国外红豆草上的壳二孢被报道为蚕豆壳二孢(A. fabae)[6]和歪头菜壳二孢(A. orobi)[7]。 该病原寄主范围广, 侵染力强, 植株的叶、茎和荚果均可被侵染[8], 以茎叶部为主, 叶部病斑多出现于叶片中间或侧缘, 病斑近圆形, 边缘深褐色; 在叶柄和茎秆上病斑梭形、椭圆形或不规则的大斑, 边缘黑色, 发生严重的植株, 病变部相连使叶柄和茎秆大部分表面变黑, 植株受害后, 严重影响红豆草的生产。
生产上防治红豆草壳二孢叶斑与黑茎病主要依赖于抗病品种的选育和化学杀菌剂拌种等手段[5, 8]。这些措施均有各自的弊端, 抗病品种的选育周期长、成本高; 长期使用化学试剂一方面容易产生耐药性菌株, 另一方面对环境造成污染, 破坏生态系统, 威胁人畜安全[9]。近年来生物防治的高效、无毒无害、无污染、不产生耐药性等优点不仅保证了生态安全, 而且为农业的可持续发展提供了保障, 因此生物防治也越来越受到重视。Wakelin等[10]从土壤分离得到的细菌芽孢杆菌(Bacillus)在室内和田间均对豌豆根腐丝囊霉(Aphanomyces euteiches)有很强的抑菌效果; Wharton等[11]用分离得到的哈茨木霉(Trichoderma harzianum)菌液处理马铃薯(Solanum tuberosum)种子后, 能够显著降低马铃薯晚疫病的发病率; Gopalakrishnan等[12]分离得到的5株放线菌菌株在温室和田间条件下均对镰刀菌起到良好的抑制效果。为探索红豆草壳二孢叶斑和黑茎病的生物防治途径, 本研究以从红豆草茎部分离得到的拮抗放线菌株为材料, 以红豆草壳二孢为指示病原, 通过形态特征、培养性状、生理生化特性以及16S rDNA基因序列分析对该拮抗菌株进行分类地位的确定和拮抗作用的初探, 旨在为红豆草壳二孢叶斑与黑茎病的生物防治研究和开发提供依据。
菌株:放线菌LYZ0255分离自红豆草茎部; 红豆草壳二孢叶斑病致病菌Ascochyta onobrychidis分离于甘肃地区栽培红豆草染病植株。
培养基:放线菌菌株的活化和培养采用高氏一号培养基; 放线菌液体发酵培养基参照范丽霞[13]筛选的小米培养基1 000 mL:小米1%, 葡萄糖1%, 蛋白胨0.5%, NaCl 0.25%, CaCO3 0.1%, (NH4)2SO4 0.1%, 红豆草壳二孢叶斑病菌的分离和培养采用马铃薯葡萄糖琼脂(potato dexterous agar medium, PDA)培养基。
1.2.1 形态学观察 依照阎逊初[14]的方法, 将拮抗放线菌划线接种在高氏一号培养基, 采用插片培养法, 在接种点斜45 ℃插入灭菌的盖玻片, 28 ℃培养1周后取出盖玻片在光学显微镜下观察菌丝形态。
用革兰氏染色观察:挑取少许待测菌株置于滴有蒸馏水的载玻片上涂片, 通过火焰3次固定。加结晶紫染色1 min, 水洗; 加碘液染色1 min, 水洗; 加95%的酒精, 脱色30~60 s, 水洗, 吸干水分; 加番红复染1 min, 水洗。吸干或在空气中晾干后, 用油镜镜检, 观察菌株形态特征[15]。
1.2.2 培养特征和生理生化特性研究 将待鉴定菌株分别接种在高氏一号、克氏一号、察氏琼脂、葡萄糖天门冬素琼脂、葡萄糖酵母膏琼脂、淀粉琼脂等培养基和马铃薯块上[16], 置于28 ℃恒温培养箱中培养, 分别在7、14和28 d观察并记录气生菌丝、基内菌丝和可溶性色素的颜色变化。取稳定期的颜色特征为期培养特征和定种依据。生理生化特性研究:参照周德庆[17]和《链霉菌鉴定手册》中所描述的方法, 采用明胶液化、牛奶凝固与胨化、淀粉水解、纤维素水解、硫化氢的产生和碳源利用试验进行待测菌株的生理生化特性测定, 测定结果与文献中所描述标准菌株的生理生化特性进行比对[16, 18]。
1.2.3 16S rDNA序列扩增与分析 待测菌株基因组的提取采用OMEGA Bacterial DNA Kit试剂盒, 按照说明书的步骤进行操作。16S rDNA序列扩增采用细菌通用引物1429R(5'-GAGAGTTTGATCCTGGCTCAG-3')和27F(5'-CTACGGCTACCTTGTTACGA-3')由上海生工生物工程技术服务公司合成[19]。PCR反应条件:95 ℃预变性3 min; 95 ℃变性30 s, 50 ℃退火30 s, 72 ℃延伸60 s, 循环30次; 72 ℃再延伸10 min。PCR扩增采用20 μ L的反应体系, 包括ddH2O 8.5 μ L, Taq酶 10 μ L, 引物1429R和27F各0.5 μ L, DNA模板0.5 μ L。PCR产物经1%的琼脂糖凝胶电泳检测后送交上海生工生物工程技术服务有限公司进行测序。将获得序列在EzBioCloud的EzTaxon数据库中进行Blast比对, 下载与待测菌株序列同源性相近的模式菌株序列, 利用MEGA6.0软件采用Neighbor-Joining(N-J)方法构建系统发育树[20]。
1.3.1 平板对峙试验 用直径5 mm的打孔器将红豆草壳二孢病原菌块接种于PDA培养皿中心, 同时用灭菌的接种针挑取单菌落放线菌接种于距病原菌3 cm处, 每皿点接4个供试菌株, 各点位置成十字形[21]; 以只接种红豆草壳二孢菌块的处理为对照, 每个处理5个重复, 22 ℃下培养, 待对照长满全皿时, 记录菌落直径, 按照如下公式计算相对抑制率。
相对抑制率=[(对照菌落直径-处理菌落直径)/对照菌落直径]× 100% 。
1.3.2 放线菌LYZ0255无菌发酵液的制备 在装有100 mL液体发酵培养基的250 mL的锥形瓶中转接两个放线菌菌饼(直径5 mm, 活化4 d), 在28 ℃、180 r· min-1条件下培养4 d。将带菌发酵液在无菌环境下取适量装入灭菌的50 mL离心管中, 在4 ℃、8 000 r· min-1下离心15 min, 去沉淀, 上清液用0.22 μ m细菌过滤器过滤, 即得含放线菌菌株的无菌发酵液(Actinomyces sterile fermentation broth, A-SFB ); 同样条件下未接种放线菌的液体培养基制成不含放线菌的无菌发酵液(sterile fermentation broth, SFB), 得到两种无菌发酵滤液保存于4 ℃冰箱中备用。
1.3.3 LYZ0255无菌发酵液对病菌菌丝生长的抑制作用测定 分别取1 mL备用的A-SFB、SFB和无菌水与9 mL无菌PDA混匀, 制成含有A-SFB、SFB和无菌水的平板培养基(无菌水平板作为对照), 用直径5 mm的打饼器取生长状况一致的红豆草壳二孢菌饼转移至各培养基中央, 在22 ℃恒温培养, 每个处理5个重复, 待对照长满全皿时, 记录菌落直径, 计算菌丝生长抑制率, 方法同1.3.1。
1.3.4 LYZ0255无菌发酵液对病菌孢子萌发抑制作用测定 采用凹片法, 分别吸取100 μ L的A-SFB、SFB和无菌水加入到凹形载玻片中的凹槽中, 再吸取等量的浓度为1× 106个· mL-1红豆草壳二孢孢子悬浮液加入到上述凹玻片的凹槽中, 将混合的凹载玻片放入到有双层灭菌滤纸的培养皿中, 在恒温培养箱中22 ℃培养, 12 h后检查孢子萌发情况, 每个处理3个重复, 每个重复显微镜下观察5个视野, 统计孢子萌发率, 计算孢子萌发抑制率[22]。
孢子萌发抑制率=[(对照萌发率-处理萌发率)/对照萌发率]× 100% 。
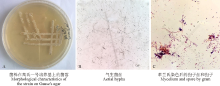
2.1.1 菌落和形态特征 在高氏一号培养基上, 28 ℃恒温条件下该手拮抗菌生长良好, 菌落黄白色(图1A); 基内菌丝无色, 无隔不断裂; 气生菌丝蛛网灰色, 呈树杈状分支(图1B); 孢子丝钩状, 顶端螺旋形(图1C), 孢子圆形或卵圆形。
拮抗菌株在大多数培养基上可产生可溶性色素, 颜色呈黄白色、琥珀色或微黄白色, 仅在察氏琼脂培养基上无可溶性色素产生; 气生菌丝多为灰白色和白色, 在淀粉琼脂培养基上呈黄色; 基内菌丝灰色、褐色、灰褐色或橙黄色, 同时该菌株在不同培养基上生长速度存在差异(表1)。
| 表1 拮抗菌株在7种培养基上的培养特征 Table 1 Cultural characteristics of the antagonistic strain on seven different media |
2.1.2 生理生化特征 参照链霉菌鉴定手册中放线菌分类所记载的生理生化试验进行测定, 结果表明, 该菌株明胶液化反应呈阳性, 且明胶液化速度快(图2A); 牛奶凝固与胨化反应呈阳性(图2B); 淀粉水解反应, 菌落周围遇碘不变色形成透明圈, 但透明圈直径小(图2C), 表明该菌株可产生淀粉酶但活性不强; 纤维素水解试验结果为弱阳性, 菌株在纤维素上有一些生长(图2D); 该菌株在柴斯纳(Tresner)琼脂培养基上没有黑色素产生, 不产生H2S; 该菌株能够利用葡萄糖、乳糖、阿拉伯糖、果糖、蔗糖、木糖和甘露醇作为碳源, 不能利用鼠李糖和肌醇。该结果与《链霉菌鉴定手册》[15]和《伯杰细菌鉴定手册》(第8版)[17]中有关微白黄链霉菌Streptomyces albidoflavus所描述的生理生化特征基本相同, 因此, 初步认为菌株LYZ0255为S. albidoflavus。
2.1.3 16S rDNA序列扩增和分析 对拮抗菌株16S rDNA序列进行PCR扩增, 得到约1 400 bp的扩增片段(图3), PCR产物测序结果显示LYZ0255的16S rDNA的全序列由1 388 bp个碱基构成。在EzTaxon数据库中比对结果显示, 与其同源性高的菌株均为链霉菌属(Streptomyces), 相似率在98.34~99.71%, 其中S. albidoflavus(Z76676)与之相似率最高, 为99.71%。基于与其同源性较高的菌株的16S rDNA的全序列构建的系统发育树结果显示, 该菌株与S. albidoflavus(Z76676)聚于同一个进化分支上(图4), 与同源性比对结果一致, 结合形态学特征和生理生化鉴定结果将拮抗菌鉴定为微白黄链霉菌S. albidoflavus。
 | 图3 菌株LYZ0255 PCR扩增结果 M: Marker; L-1/L-2: LYZ0255扩增序列。Fig. 3 Polymerase chain reaction amplification results of the strain LYZ0255 L-1/L-2: The amplification sequence of LYZ0255. |
2.2.1 对菌丝生长的的抑制效果 平板对峙试验结果表明, 该链霉菌菌株对红豆草壳二孢表现出很强的拮抗作用, 在对照长满全皿, 对照平板上红豆草壳二孢直径为63.1 mm时, 对峙平板中红豆草壳二孢直径为16.2 mm(图5), 相对抑菌率达74.33%。
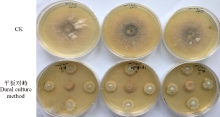 | 图5 拮抗菌对红豆草壳二孢菌丝的平板对峙试验Fig. 5 Dural culture method of the antagonistic strain inhibit Ascochyta onobrychidis |
拮抗菌株无菌发酵液对菌丝抑制结果显示, 待对照长满全皿时, A-SFB平板病原菌菌落直径与SFB处理、对照均呈极显著差异(P< 0.01), 其中A-SFB平板对菌丝生长的抑菌率达80.95%(图6), 对红豆草壳二孢病菌菌丝表现出很强的抑制作用; 而SFB平板菌落生长状况与无菌水处理一致, 均对红豆草壳二孢菌丝生长没有抑制作用。
2.2.2 对孢子萌发的抑制作用 用A-SFB处理红豆草壳二孢病原菌孢子, 其抑制病原孢子萌发效果显著, 抑制率达93.87%; 而SFB处理和对照处理一致, 红豆草壳二孢病原孢子多数已经萌发(图7), 说明SFB对红豆草病原菌孢子萌发没有影响。
目前, 对于红豆草壳二孢引起的叶斑和黑茎病防治研究甚少, 只通过室内接种筛选出埃斯基为抗病品种[8], 和仅通过平板对峙发现沙打旺埃里砖隔孢对红豆草壳二孢有一定的抑制作用[23], 因此寻找经济高效、能够保证生态安全和具有开发潜力的生物防治手段是解决这一问题的有效途径。本研究通过对分离得到的一株明显抑制红豆草壳二孢生长的放线菌菌株进行形态鉴定和16S rDNA序列分析, 将其鉴定为微白黄链霉菌, 该菌株在形态特征、培养特征、生理生化特征以及16S rDNA序列等方面参考模式菌株的相关信息[15, 22]与微白黄链霉菌基本一致, 只在碳源利用方面与模式菌株存在细微差异, 模式菌株不能利用蔗糖, 而该菌株可以利用, 这可能是菌株之间存在变异的结果; 同时拮抗菌株无菌发酵液对病原菌菌丝和孢子萌发的抑制试验结果均显示, SFB处理和对照结果相同, 排除了SFB对病原菌的影响, 起抑制作用的即为该拮抗菌株。
链霉菌在植物病害生物防治方面被广泛应用于真菌引起的病害, 并且利用链霉菌的代谢产物开发成微生物源农药防治植物病害是其在生物防治中最主要的应用形式, 第一个实用化的农用抗生素杀稻瘟菌素能显著抑制水稻纹枯病菌。有研究表明, 微白黄链霉菌具有抗菌活性, Chao等[24]发现微白黄链霉菌可以有效抑制叶霉病菌(Passalora fulva), 本研究通过该拮抗放线菌平板对峙试验和无菌发酵液对病原菌菌丝生长以及孢子萌发影响的测定, 证明了微白黄链霉菌对红豆草壳二孢有良好的抑制作用, 说明其在红豆草壳二孢叶斑和黑茎病生物防治和应用中潜力巨大, 但是该菌株发酵液中哪些成分在起抑制作用、作用机理和温室及大田防效等问题还需进一步探究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|